Муниципальное общеобразовательное учреждение «Тавровская средняя общеобразовательная школа им. А.Г. Ачкасова» Белгородского района Белгородской области
Исследовательская работа
Водные ресурсы Белгородской области
Учитель биологии Коцюбинская Лидия Ивановна
2010-2011 учебный год
СОДЕРЖАНИЕ
Введение
Глава 1. Вода на нашей планете
1.1 Роль воды в биосферных процессах
1.2 Аномальные свойства воды
1.3 Вода- среда жизни
1.4 Объемы воды в составляющих гидросферы
1.5 Общие ресурсы пресной воды
Глава 2. Характеристика воды. Жесткость воды
Глава 3. Водные ресурсы Белгородской области
3.1 Состояние водных ресурсов Белгородской области
3.2 Гигиена водоснабжения и здоровье населения
Глава 4. Определение качества природной воды. Методики химического анализа воды
4.1 Отбор проб воды для физико-химического анализа
4.2 Методики работы
• Определение запаха
• Определение цветности
• Определение карбонатной жесткости
• Определение общей жесткости
Глава 5. Результаты исследования
Заключение
Список используемой литературы
ВВЕДЕНИЕ
Вода – самое удивительное и самое распространенное
природное соединение – источник жизни и условие ее
формирования на Земле.
(«Жизнь есть одушевленная вода», Э.Дюбуа).
На современном этапе развития области одним из главных резервов повышения эффективного материального производства является рациональное использование природных ресурсов.
Загрязнение природной среды вредными веществами, сбрасываемыми в атмосферу и в водные объекты в результате деятельности различных отраслей народного хозяйства, остается острой проблемой, имеющей приоритетное социальное и экономическое значение.
Вода — самое распространенное на земле вещество. Почта 34 поверхности земного шара покрыты водой, заполняющей все природные водоемы и образующей океаны, моря, реки и озера. Много воды находится в газообразном состоянии в виде паров в атмосферу, огромными массами снега и льда лежит вода круглый год на поверхности земли, но и в земной коре находится вода.
Природная вода никогда не бывает совершенно чистой. Наиболее чистой является дождевая вода, но и она содержит различные примеси, которые захватывает из воздуха, например, растворимые газы, пыль, микроорганизмы. Также такая вода содержит большое количество солей Са и Mg во взвешенном состоянии, твердые частицы песка, глины, остатки растений и животных.
Крайне актуальной в настоящее время является проблема загрязнения водных объектов (рек, озер, морей, грунтовых вод и пр.). Реки являются основными источниками водоснабжения населения.
Водные объекты следует рассматривать как часть экономического потенциала нашего района. В то же время развитие народного хозяйства и улучшение условий и качества жизни населения обуславливает повышение требований к экологическому состоянию поверхностных и подземных вод. Поэтому охрана водных ресурсов одна из наиболее важных проблем, которая особенно остро проявляется во многих районах нашей области.
На сегодня село Таврово — это комплекс частного строительства и ввода в эксплуатацию большого количества кв. м жилой площади. Проблема нормального водоснабжения стоит остро перед жителями села. Хотя МУП «Гороводоканал» и ввел в работу очередную скважину, поддерживает в рабочем состоянии имеющиеся, но воды не хватает.
Цель нашей работы: изучить поверхностные воды с. Таврово.
Задачи, стоящие перед нами в работе:
1. Определить цвет и запах воды
2. Определить карбонатную жесткость
3. Определить общую жесткость
Гипотеза: состояние водных ресурсов в с. Таврово в 2010 году улучшилось по сравнению с 2002 годом.
I. Вода на нашей планете.
1.1 Роль воды в биосферных процессах
Вода — самое распространенное вещество на земле, изначально существовавшее на нашей планете.
Молекулы воды, состоящие из двух атомов водорода и одного атома кислорода, образуют исключительно устойчивое химическое соединение, которое может существовать в самых разных условиях — в космосе, на поверхности Земли и в ее мантии.
Вода — одна из наиболее важных жизнеобеспечивающих природных сред, образовавшихся в результате эволюции Земли. Она составная часть биосферы, обладает целым рядом аномальных свойств, определяемых структурой ее молекулы, и влияющих на протекающие в экосистемах физико — химические и биологические процессы.
1.2 .Аномальные свойства воды.
Как известно, свойства простых и сложных веществ находятся в зависимости от их относительной молекулярной массы. С этой точки зрения вода должна быть подобна химическим соединениям водорода с другими элементами VI группы периодической системы химических элементов Д.И Менделеева: серой (H2S), селеном (Н2Se) и теллуром (Н2Те), т.е. кипеть при -70С и замерзать при — 90С.
Если бы вода обладала такими свойствами, то на Земле она могла бы существовать только в виде пара. Однако вода, в отличие от приведенных веществ, имеет очень высокие температуры замерзания (ОС) и кипения (100С). Это позволяет ей существовать на нашей планете во всех агрегатных состояниях (водяной пар атмосферы, Мировой океан, ледники), что имеет большое значение для геологических, климатических, биологических процессов Земли.
Вода обладает уникальными тепловыми характеристиками во всех ее агрегатных состояниях — очень высокими теплотой плавления льда, теплотой испарения, теплопроводностью. Из всех природных твердых и жидких веществ вода обладает наибольшей теплоемкостью: удельная теплоемкость воды при нормальных условиях составляет 4,19 кДж /(кг* град). Это делает воду, при том ее количестве, которое имеется на Земле, планетарным аккумулятором тепла, а с учетом круговорота воды, охватывающего все подразделения биосферы, и планетарным переносчиком тепла.
Вода — мощный тепловой стабилизатор, обеспечивающий устойчивый климат на планете в течение тысячелетий. Парниковый эффект, обусловленный присутствием в атмосфере водяного пара и углекислого газа, обеспечивает среднегодовую температуру у поверхности Земли порядка 15С, при этом на долю водяного пара приходится 60% теплового излучения, отражаемого земной поверхностью. Уменьшение содержания теплового пара в атмосфере наполовину вызвала бы понижение температуры у поверхности Земли до катастрофического значения -5С.
1.3. Вода — среда жизни.
В ходе эволюции вода создала окружающую нас природу; живой мир, да и самого человека: именно водная среда (Мировой океан) могла обеспечить все требования к возникновению и развитию жизни. Она стала тем «питательным бульонам», в котором 3,5 млрд. лет при специфических внешних условиях зародилась жизнь на Земле.
Вода обеспечивает существование жизни на нашей планете: сложнейшие биохимические реакции в клетках животных и растительных организмах могут протекать только при наличии воды. Все живые существа на Земле содержат воду в большем или меньшем количестве, в среднем около 70 — 80 %, т.е. на 3/4 состоят из воды. С химической точки зрения живое вещество — это водный раствор, и почти все процессы, обеспечивающие его жизнедеятельность, сводятся к химическим реакциям в водном растворе.
Для поддержания жизни человек должен получать около 2,5 л воды в сутки. В среднем человек за всю жизнь потребляет и выделяет около 75 т воды, а все человечество — почти четвертую часть годового стока всех рек мира. Без воды человек не проживет и недели, погибнет от жажды. Обезвоживание организма приводит к серьезным нарушениям функционирования различных органов. Человек тяжело переносит потерю 5 % воды, а обезвоживание на 15 — 25 % приводит к необратимым изменениям в организме и к смерти.
Круговорот воды в природе — это непрерывный процесс движения и обмена водой между различными составляющими гидросферы. Примерно за 3000 лет вся современная масса гидросферы испаряется, т.е. интенсивность возобновления воды достаточно велика. Обладая в миллион раз меньшей массой воды, чем масса гидросферы, живые организмы, главным образом растения, пропускают ее через себя (за время порядка одного миллиона лет). Таким образом, природная вода это тоже продукт жизнедеятельности живых организмов. В круговороте воды на суше доминирующая роль принадлежит растениям, 2/3 осадков образуется за счет транспирации — испарения с поверхности листьев растений.
1.4 Объемы воды в составляющих гидросферы
Около 70% поверхности Земли (361,2 млн. км2) покрыто водой морей и океанов. Вся же гидросфера занимает значительно большую поверхность, если учитывать ледники, озера и реки, а также болота и сильно увлажненные земли. Таким образом, гидросфера на нашей планете — это основная часть ее поверхности: более 380 млн. км2, или свыше 75% площади поверхности Земли. Гидросфера земли содержит около 104 млрд. км3 воды (приложение 1)
1.5 Общие ресурсы пресной воды
Большое значение для жизни на Земле и хозяйственной деятельности имеет водный баланс пресной ветви планетарного круговорота воды. Пресной считается вода, в 1 л которой содержится не более 1 г растворенных веществ (солей). Другими словами, пресная вода- это вода с соленостью не более одной промилле. Для сравнения: средняя соленость морской воды составляет 35 промилле.
Основные запасы пресной воды на Земле сосредоточены в снежно-ледовых образованиях и в подземных водах около 35 млн.км3 или 25% от всего объема воды в гидросфере. Хотя снежно — ледовые образования и подземные воды и играют существенную роль в водоснабжении некоторых районов, все же они труднодоступны, и в мировом масштабе их использование пока не имеет практического значения. Кроме того, пресные подземные воды располагаются лишь до глубины активного водообмена, формирующегося за счет атмосферных осадков, т.е. до глубины 200 -1500 м.
Непосредственно доступные пресные воды (пресные озера, содержащие 91 тыс. куб. км воды и реки) составляют лишь 0,007% от всей воды на Земле. Самое большое в мире по запасам пресной воды оз. Байкал содержит 23 тыс. куб. км воды, столько же Великие американские озера. Таким образом, на эти озера приходится половина запасов воды пресных озер всего мира. Структура водного фонда России такова:
— Мировой океан 93,6%
— Подземные воды 4%
— Ледники, снежный покров 2%
— Реки, озера и другие источники пресной воды 0,4%
Для определения степени обеспеченности регионов водными ресурсами необходимо рассчитывать удельные характеристики: объем воды, приходящийся на единицу территории или на одного человека.
В среднем на одного жителя Земли приходится 8 тыс. куб. м /год, для Азиатского континента эта величина равна 5;2 тыс. куб. м/год. За последние 20 лет произошло существенное уменьшение водообепеченности Азии, Африки и Южной Америки в связи с демографическим взрывом в этих районах.
Если рассматривать отдельные страны, то более других обеспечена пресной водой Бразилия (свыше 140 тыс. куб. м/год), где располагается бассейн крупнейшей реки мира — Амазонки, на втором месте по суммарному стоку (около 30 тыс. куб.м /год) стоит Россия.
Однако средние показатели по материкам и даже по странам не могут дать истинного представления об обеспечении водой. Это объясняется неравномерным распределением водных ресурсов по территории.
Наглядный пример — ситуация с водными ресурсами, сложившаяся в России. В целом, Россия богата водными ресурсами: средне многолетний суммарный речной сток в Российской Федерации составляет 4270 куб. км/год. Распределение речного стока по территории России крайне неравномерно и не соответствует расселению жителей, а также размещению производительных сил.
Около 90% общего поверхностного годового стока приходится на восточные районы страны, где проживает только около 25% населения страны. На европейскую часть, где сосредоточен основной промышленный и сельскохозяйственный потенциал страны, находятся крупные города и живет большая часть населения, приходится лишь 10% от общего годового речного стока. Таким образом, хозяйственно освоенные районы Российской Федерации испытывают недостаток пресных водных ресурсов уже в силу только географических причин.
II. Характеристики воды. Жесткость воды.
Состав и свойства вода зависят в первую очередь от условий ее формирования. В биосфере в процессе круговорота воды ее химический состав может существенно изменятся.
Вода ни в одном из ее природных форм не бывает чистой. Самая чистая вода — это метеоритная Н2О, однако и она содержит растворенные газы и др. свойства, содержащиеся в атмосфере.
Так, например, среднее содержание солевых ионов в атмосферных осадках на территории нашей страны характеризуется следующими цифрами:
| Na+ | Са2+ | Мg2+ | К+ | НСОз— | SO42- | С1— | N03— | |
| Содержание в мг/л | 5,1 | 4.8 | 1,7 | 0,2 | 18,2 | 9,2 | 5,5 | 1,7 |
Метеоритная вода, попадая на Землю, может пройти через водопроницаемые слои: почву, песок до водопроницаемого слоя: глину; где образует подземные озера. Подземная вода в зависимости от рельефа местности снова появляется на земной поверхности, образовывая реки, или может быть искусственно извлеченной из колодцев, химический состав такой воды зависит от земных слоев, через которые она проходила, и от продолжительности контакта с ними.
Природная вода всегда содержит различные примеси. Вода, содержащая соли кальция и магния называется жесткой. В жесткой воде не пенится мыло, при ее кипячении образуется накипь. Поэтому часто приходится устранять жесткость воды.
Жесткость воды может быть временной, которая устраняется при кипячении, и постоянной, которая не устраняется при кипячении.
Временная жесткость воды обусловлена наличием в ней гидрокарбонатов кальция и магния Са(НСОз)2- и Mg(HC03)2-. Поэтому ее называют также карбонатной жесткостью. При кипячении гидрокарбонаты разлагаются:
Са(НС03)2 = СаС03 + С02 + Н2
Постоянная, или некарбонатная жесткость, обусловлена содержанием, главным образом, хлоридов и сульфатов кальция и магния.
Мягкую воду можно получить, добавляя к жесткой воде соду и гашеную известь для одновременного устранения временной и постоянной жесткости.
Для умягчения воды используют различные катионы. Например, при пропускании жесткой воды через катион типа RNa протекают следующие процессы ионного обмена:
2RNa + Са2+ = R2Ca + 2Na+
2RNa + Mg2+ = R2Mg + 2Na+
Степень жесткости воды измеряется по-разному. В нашей стране ее выражают числом мили эквивалентов катионов Са2+ и Mg2+, которые содержатся в 1л воды, так как одним мили эквивалентом жесткости отвечает содержанию 20,04 мг катионов Са2+ или 12,16 мг катионов Mg2+, то общую жесткость воды в мэкв/литр по формуле:
[Са2+] [Mg2+]
Ж общая =————-+——————где
20,04 12,16
[Са2+] и [Mg2+] — концентрация соответствующих ионов Са2+ и Mg2+ в мг/л. (приложение 2)
Жесткость воды для хозяйственно — питьевых водопроводов не должна превышать 7 мэкв/л.
Жесткость природной воды изменяется в широких пределах. Она различна в различных водоемах, а в одном и том же месте может меняться в течение года.
III. Водные ресурсы Белгородской области.
3. 1 Состояние водных ресурсов Белгородской области
Белгородская область принадлежит к числу маловодных регионов России. Поверхностными водами рек, ручьев, озер, водохранилищ, прудов и болот занято около 1% территории области.
По территории области протекает около 500 балок, рек и ручьев, в том числе 123 средних, малых, самых малых рек и ручьев. Большинство из них относится к малым и самым малым рекам протяженностью от 10 до 100 км. Длину более 100 км в пределах области (средние реки) имеют 4 реки: Оскол (226 км), Ворскла (118 км), Тихая Сосна (105 км) и Северский Донец (102 км). Общая протяженность балочно-речной сети составляет около 5000 км, в том числе 3627 км водотоков. Водотоки относятся к бассейнам рек Дон (80%) и Днепр (20%).
Реки имеют, преимущественно, снеговое питание. На его долю приходится 55%-60% годового стока (на грунтовое – 35%-40%, дождевое — 10%-15%).
На территории области имеются около 1000 прудов и водохранилищ, в том числе 421 из них – объемом более 100 тыс. куб. м. Объем самых крупных водохранилищ составляет 87,1 млн. куб. м (Старооскольское водохранилище) и 76 млн. куб. м (Белгородское водохранилище).
Загрязнителями водных объектов и подземных водоносных горизонтов являются свыше 70 промышленных и сельскохозяйственных объектов Белгородской области. Наибольшее влияние на процессы загрязнения водных объектов оказывают сточные воды коммунальных служб.
Одно из живописных мест Таврово – пруд – любимое место отдыха жителей села. Он был вырыт помещиком Яковом Николаевичем Говорухо – Отроком в конце 19 века специально для купания помещичьей семьи. Крестьянские дети купались в специальном водоеме, который не сохранился до наших дней.
Пруд в селе Таврово находится в низине. С одной стороны он окружен лесом с близ лежащей гостиницей, а с другой — частным сектором с приусадебными участками. В 1983 году пруд очистили, была благоустроена зона отдыха: завезен песок, сделаны мостики, раздевалки. В последнее время ухудшилось экологическое состояние леса, где находится пруд. Зачастую берег пруда являлся не только излюбленным местом отдыха местных жителей, но и местом свалки бытовых отходов, местом постоянного слива сточных вод.
Поэтому серьезную озабоченность вызывает экологическое состояние, как самого пруда, так и прибережной зоны.
Вопрос об очистке прибережной зоны и самого пруда стоит перед администрацией села очень остро. В настоящее время водоем взят в аренду, ведутся работы по благоустройству. Часть воды из пруда была спущена для дальнейшей очистки дна. В течение трех лет проводятся многократные массовые рейды по очистке прилегающих территорий к пруду, в которой активное участие принимают школьники.
Подземные воды, в основном, приурочены к каменноугольным, юрским и неоген — палеогеновым отложениям. Подземные воды до глубины 500 метров пресные и слабо пресные, на глубинах до 500 м встречаются также солоноватые и слабосолоноватые. Подземные воды на территории Белгородской области является источником водоснабжения. В настоящее время практически все водозаборы области используют воды водоносных горизонтов, где имеется прямая гидравлическая связь с поверхностью. При этом на состояние подземных вод оказывают существенное влияние предприятие ООО «Таоспектр».
В настоящее время централизованного наблюдения за состоянием подземных вод на всей территории не проводится. Поэтому произвести полную оценку ресурсов и баланса подземных вод, а также оперативно выявлять очаги загрязнения, и распространения этих загрязнений полностью невозможно.
Существенное влияние на загрязнение водоносных горизонтов оказывают водозаборные скважины поселков, предприятий, расположенных в сельской местности, где сооружение скважин осуществляется без изоляции водоносного горизонта от поверхности.
3.2. Гигиена водоснабжения и здоровья населения.
В 2009 году на территории области числилось 633 водопользователей. Общий среднегодовой отбор подземных вод в 2009 году составил 762,6 тыс.куб.м/сут. Из них 326,85 тыс.куб.м/сут. используются в системе хозяйственно-питьевого водоснабжения; 303,74 тыс.куб.м/сут. составляют дренажные воды 4-х действующих горно-добывающих предприятий области и 40% из них сбрасываются без использования. Остальные объемы дренажных вод расходуются на производственно-техническое водоснабжение, в основном, в системе обогащения руды и транспортировки хвостов. В производственно-техническом водоснабжении среднегодовое потребление составило 255,26 тыс.куб.м/сут.
Из 326,85 тыс.куб.м/сут. хозяйственно-питьевого водопотребления на водоснабжение городского населения приходится 276,27 тыс.куб.м/сут., на водоснабжение сельского населения – 50,58 тыс. куб.м/сут.
На участках с утвержденными запасами хозпитьевых вод водоотбор составляет около 561,53 тыс.куб.м/сут.
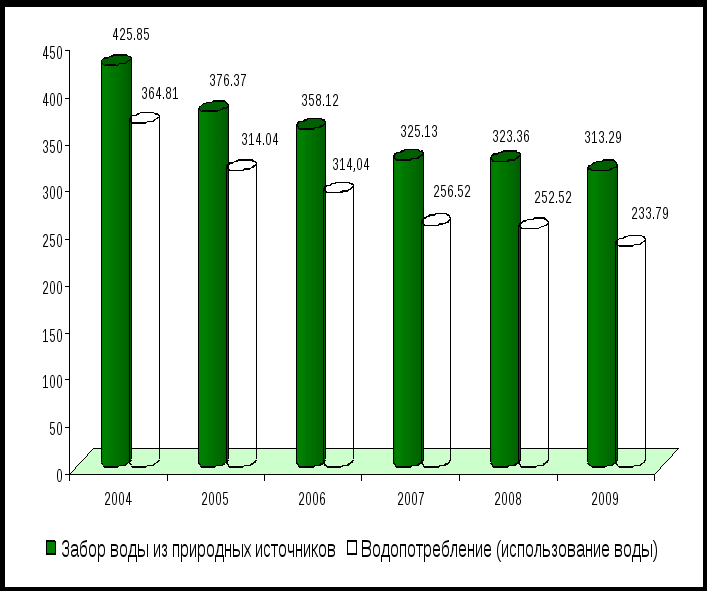
В области имеется 491 водопользователь. Общий забор воды в 2009 году составил 313,29 млн. куб. м (в 2008 году – 323,36 млн. куб.м), в том числе из подземных источников – 280,65 млн.куб.м (в 2008 году – 276,00 млн.куб.м), из поверхностных – 32,64 млн. куб. м (в 2008 году – 47,36 млн. куб.м).
Использование воды в 2009 году составило 233,79 млн.куб.м, в том числе на нужды: хозяйственно-питьевые – 109,05 млн. куб. м, производственные – 99,62, прудово-рыбного хозяйства – 8,31, орошение – 0,66, сельхозводоснабжение – 16,15 млн. куб. м (приложение 3)
Из общего объема использованной воды объем поверхностных вод составляет 32,58 млн. куб. м, подземных – 201,21 млн. куб. м.
(миллионов кубических метров)
(в процентах от общего объема использования воды)

2009 г.

С 1996 года в области ведется работа по улучшению хозяйственно — питьевого водоснабжения; строительство водозаборов, а также происходит расширение и реконструкция объектов водоснабжения.
Так на данный момент для жителей села стоит остро проблема постройки дополнительного водозаборов.
Поэтому питьевая вода в селе подается под большим наблюдением, особенно летом, в разгар огородных работ.
Хочется привести еще одну цифру: в 1996году 27,2% источников централизованного водоснабжения Белгородской области не отвечали санитарным требованиям. В 2009 году не отвечают санитарным требованиям 25,5 % источников.
Хотя у нас в селе и применяются меры по улучшению качества воды, но вместе с тем, степень бактериального загрязнения высока. Так в 2001 году в селе была -зарегистрирована вспышка вирусного гепатита А, связанная по всей видимости, с использованием недоброкачественной питьевой воды.
В целях улучшения хозяйственно — питьевого водоснабжения населения области необходимо: решить вопросы материально — технического и финансового обеспечения служб эксплуатации объектов хозяйственно — питьевого водоснабжения.
IV Методика химического анализа.
Объект исследования: Тавровский пруд
Предмет исследования: поверхностные воды лесного пруда
Методы исследования:
изучение научной литературы по состоянию водных ресурсов Белгородской области;
проведение биохимических исследований
IV. 1. Отбор проб воды для физико-химического анализа
Отбор проб воды является важным этапом во всем комплексе исследования воды. Результаты анализа в значительной степени зависят от правильности проведения этой операции.
Различают две основные пробы: разовую и среднюю. Разовую пробу получают путем отбора требуемого объема воды за один раз. Средняя проба получается путем смешивания равных объемов проб, отобранных через равные промежутки времени. Средняя проба тем точнее, чем меньше интервалы между ними.
Для краткого анализа можно взять бутыль емкостью 2 л с притертой или корковой пробкой. Бутыль должна быть чисто вымыта и ополоснута дистиллированной водой. Отбор проб можно провести бутылью, к которой прикрепляется груз. Бутыль закрывают пробкой, к которой прикреплен шнур. С водоемов пробу отбирают на расстоянии 0,5 — 0,75 метров от поверхности и дна водоемов и не ближе чем 1.5-2 метра от берега. Пробку из бутыли вынимают под водой при помощи шнура. Перед отбором воды бутыль споласкивают отбираемой водой 2-3 раза, затем наполняют водой до верха и закрывают так, чтобы пробка не дотрагивалась до воды.
Хранение проб воды. Отобранную воду рекомендуется исследовать в день отбора проб. В случае невозможности проведения анализа в день отбора проб, ее можно хранить в холодильнике не более 3-х суток с момента отбора.
При длительном стоянии пробы могут произойти существенные изменения в составе воды, поэтому, если нельзя начать анализ воды сразу после отбора или через 12 часов после него, ее консервируют. Добавляют 2-4 мл хлороформа на каждый литр пробы, если в ней будут определять азотсодержащие соединения. В случае определения железа, алюминия, меди, цинка к ней добавляют концентрированную соляную кислоту из расчета 3 мл на каждый литр пробы. При определении марганца, свинца для консервации используют 3 мл концентрированной азотной кислоты на 1 литр воды. Универсального консервирующего средства не существует.
Не консервируют воду для определения органолептических показателей, общей жесткости, хлоридов, сульфатов и др.
IV.2 Методика работы
Определение запаха. Запах воды водоемов не должен превышать 2 баллов, обнаруживаемых непосредственно в воде. Определение основано на органолептическом исследовании характера и интенсивности запаха воды при 20° и 60°.
Запах в воде обусловлен наличием в ней летучих и пахнущих веществ, которые попадают в неё естественным путем или сточными водами. По характеру запахи делятся на две группы.
1.Запахи естественного происхождения описываются по следующей терминологии.
| Характер запаха | Примерный род запаха | |
| А | Ароматический | Огуречный, цветочный |
| Б | Болотный | Илистый, тинистый |
| Г | Древесный | Запах мокрой щепы, древесный |
| 3 | Землистый | Прелый, свежевспаханной земли |
| Р | Рыбный | Рыбы, рыбьего жира |
| С | Сероводород | Тухных яиц |
| т | Травянистый | Сена, скошенной травы |
| н | Неопределенный | Не подходящий под предыдущие определения |
Чистые природные воды запахов не имеют.
2.Запахи искусственного происхождения (от промышленных выбросов, для питьевой воды — от обработки воды реагентами на водопроводных сооружениях и т.п.) называют по соответствующим веществам: хлорфенольный, камфорный, бензиновый, хлорный и т.п.
Интенсивность запаха оценивают по пятибалльной системе, приведенной в таблице.
| Интенсивность запаха | Описание определения | |
| О | Никакого | Отсутствие ощутимого запаха |
| 1 | Очень слабый | Запах, обнаруживаемый опытным исследователем |
| 2 | Слабый | Запах, не привлекающий внимания, но такой, который можно заметить, если указать на него |
| 3 | Отчетливый | Запах, обращающий на себя внимание и делающий воду непригодной для питья. |
| 4 | Заметный | Запах, легко обнаруживаемый и могущий дать повод относиться к воде с неодобрением. |
| 5 | Очень сильный | Запах настолько сильный, что делает воду непригодной для питья. |
Водой, не имеющей запаха, считается та, запах которой не превышает 2 балла.
Ход анализа.
100 мл исследуемой воды при 20°С наливаем в колбу вместимостью 150 — 200 мл с широким горлом, накрываем часовым стеклом или притертой пробкой, встряхиваем вращательным движением, открываем пробку или сдвигаем часовое стекло и быстро определяем характер и интенсивность запаха. Затем колбу нагреваем до 60°С на водяной бане и также оцениваем запах.
Определение цветности
Питьевая вода должна быть бесцветной. Цветность природной воде могут придавать соединения железа (желто — зеленоватое окрашивание), цветущие водоросли, взвешенные частицы. Различные оттенки вода может приобретать и за счет загрязнения ее сточными водами. Окраску воды определяют визуально.
Реактивы. Дистиллированная вода.
Оборудование.
Цилиндр с плоским дном из бесцветного стекла, белый лист бумаги.
Ход анализа.
Профильтрованную пробу воды наливаем в цилиндр и ставим на лист бумаги рядом с цилиндром с дистиллированной водой. Высота столба воды должна быть равна 10 см. Рассматриваем пробу в цилиндре при рассеянном дневном освещении. Результат определения описываем словесно с указанием оттенка и интенсивности окрашивания (бесцветная; слабо — желтая, красноватая, фиолетовая и т. д.).
Определение карбонатной жесткости воды
С помощью стандартного раствора соляной кислоты можно определять не только содержание щелочей, но и содержание некоторых солей. Практическое значение имеет определение жесткости воды. Жесткость воды изучают, чтобы выяснить их пригодность для растениеводства и животноводства, а также для технических целей. Под жесткостью понимают суммарное содержание в воде солей кальция и магния. Общую жесткость определяют комплексометрическим методом, а карбонатную или временную жесткость — методом нейтрализации. Карбонатная жесткость зависит от содержания в воде гидрокарбонатов кальция и магния. Она почти полностью устраняется кипячением, при котором гидрокарбонаты разлагаются:
Са(НС03)2 = СаСОз + С02 + Н2
Поэтому карбонатную жесткость называют также устранимой или временной. Карбонатная жесткость отвечает той части катионов кальция и магния, которая эквивалентна содержащимся в воде анионам гидрокарбонатов этих металлов. Жесткость принято выражать в моль экв/л.
Ход определения.
Помещаем 100 мл исследуемой воды в коническую колбу. Прибавляем 2 -3 капли индикатора метилоранжа, перемешиваем и титруем раствором НС1 до перехода желтой окраски индикатора в оранжевый цвет. Титрование повторяем не менее трех раз, до получения хорошо сводимых результатов. При этом протекают реакции:
Са(НС03)2 + 2НС1 = СаС12 + 2С02 + 2Н2
Mg(HC3)2 + 2НС1 — MgCl2 + 2С02 + 2Н2
Способ основан на предположении, что вода не содержит кислых углекислых солей других металлов, например кислого углекислого натрия.
Определение общей жесткости.
Под общей жесткостью понимают суммарное содержание ионов кальция и магния в воде, выраженное в ммоль экв/л. Она складывается из карбонатной (временной) и некарбонатной (постоянной) жесткости воды. Некарбонатная жесткость обусловлена наличием в воде сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов.
Жесткость воды колеблется в широких пределах: от 0,1 — 0,2 ммоль экв/л в реках и озерах, расположенных в зонах тайги и тундры; до 80 ммоль экв/л и более — в подземных водах, морях и океанах.
Различают воду мягкую (общая жесткость до 2 ммоль экв/л), средней жесткости (2-10 ммоль экв/л) и жесткую (более 10 ммолъ экв/л). В поверхностных водах преобладает, как правило, карбонатная жесткость (70-80% от общей). Наибольшее значение жесткость воды достигает в конце зимы, а наименьшего — в период паводка. Так, в реке Волге (г. Нижний Новгород) максимальная жесткость бывает в марте (4,3 ммоль экв/л), а минимальная — в мае (0,5 ммоль экв/л). В подземных водах жесткость воды наиболее постоянна и меньше изменяется в течение года.
Повышенная жесткость способствует усиленному образованию накипи в паровых котлах, отопительных приборах и бытовой металлической посуде, что значительно снижает интенсивность теплообмена. В воде с высокой жесткостью плохо развариваются овощи, мясо, так как катионы кальция образуют с белками пищевых продуктов нерастворимые соединения. Большая магниевая жесткость придает воде горький привкус, поэтому содержание магния должно превышать 100 мг/л. Общая жесткость питьевой воды во избежание ухудшения ее органолептических свойств должна быть не более 7 ммоль экв/л.
Для устранения или уменьшения жесткости воды применяют специальные методы. Из реагентных методов наиболее распространен известково-содовый, а при комбинировании его с ионообменными методами можно получить глубоко умягченную воду.
Ход работы.
Помещаем 100 мл исследуемой воды в коническую колбу. Прибавляем 20 мг аммонийного буферного раствора (рН = 10) и на кончике шпателя — несколько кристалликов индикатора эриохрома черного Т или кислотного хром темно-синего. Раствор перемешиваем после появления винно-красной окраски, титруем 0,05 н раствором трилона Б до перехода окраски в синюю. Титрование повторяем не менее трех раз, до получения хорошо сходимых результатов.
При этом протекают реакции:
Са2+ + Hind2 = Calnd + Н+ Mg2+ + Hind2 = Mglnd + H+
вино — красный вино — красный
Константы нестойкости этих комплексов равны соответственно
3,9*10—6 и 1*10-7. Но константы нестойкости комплексов Са2+ и Mg2+ с комплексом гораздо меньше (2,7*10 -11 и 2*104). Поэтому при титровании металлов и индикаторов разрушаются и образуется более прочные комплексы.
Calnd + Na2[H2Y] = [CaY] + Nalnd + 2H+
вино — красный синий
V. Результаты исследования.
1. Запах неопределенный, интенсивность запаха 2 балла (слабый).
2. Цветность: вода имеет зеленоватый оттенок, интенсивность окрашивания слабая.
3. Определение карбонатной жесткости.
Ж = Nhci * VHcl * 10 мг экв, где
Nhci — нормальность раствора НС1
Vнcl— объем НCl, затраченный на титрование 100 мл анализируемой воды
Ж = 0,1*10,2*10=10.2 ммоль экв/л
Карбонатная жесткость равна 10,2 ммоль экв/л.
4. Среднее значение общей жесткости воды 4,875 ммоль экв/л.
Вода в с. Таврово средней жесткости, т.к. значение жесткости находится в промежутке от 4 до 8.
В результате проделанной работы мы приходим к выводу, что в исследуемой воде из лесного пруда много органических веществ. Запах у исследуемой воды неопределенный, слабый; цвет — зеленоватый. Карбонатная жесткость составляет 10,2 ммоль экв/л. Показатель общей жесткости воды составляет 4,875 ммоль экв/л. Данная вода имеет средний показатель жесткости.
В 2002 году мы проводили исследование воды этого пруда и пришли тогда к выводу, что все показатели воды (определение хлорид — и сульфат — ионов, перманганатная окисляемость) свидетельствовали о многочисленной гибели беспозвоночных и мелких позвоночных животных. Эти результаты были доведены до администрации с. Таврово. В результате на сегодняшний день воду пруда сначала практически полностью спустили, затем очистили дно и всю прибрежную полосу с помощью техники и заново заполнили.
Заключение.
В данной работе дан анализ как научно-теоретического, так и практического аспекта исследования поверхностных вод лесного пруда.
Изучение жесткости воды показало ее пригодность для растениеводства и животноводства, а также для технических целей.
Для того чтобы исключить загрязнение окружающей среды бытовыми и промышленными отходами, предотвратить возникновение и распространение заболеваний людей, связанных с накоплением отходов, необходимо:
Разработать схему санитарной очистки села.
Создать службу санитарной очистке на селе.
Обеспечить предприятия жилищно-коммунального хозяйства специализированным транспортом, мусоросборниками в необходимом количестве.
Осуществить программу строительства предприятий и полигонов по утилизации всех видов отходов.
Экологической программой г. Белгорода (на 2007-2011 годы) по охране водных объектов также предусматривается:
Поэтапное достижение МУП «Говодоканал» нормативов очистки промстоков, в результате чего снизится загрязнение водных объектов за счет организации системы обращения с бытовыми отходами.
Строительство II очереди полигона ТБО вне зоны санитарной охраны 5-го водозабора, что положительно скажется на охране водных запасов города. Будет разработана перспективная схема развития и реконструкции ливневой канализации города.
Фомирование муниципальной системы управления водными ресурсами, что обеспечит рачительное отношение к водным запасам, особенно к водам юрского водоносного горизонта.
Итогом комплекса организационных и экономических мер должно стать снижение водопотребления населением до 200 л/сутки на человека. Выполнение мероприятий программы приведет к снижению индекса загрязнения рек с 3,5 до 3,3.
Список литературы:
В.В. Синюков «Вода известная и неизвестная», издательство «Знание», Москва, 1987
Балятинская Л.Н. и др. Химия приоритетных загрязнителей окружающей среды: — Белгород, 1992
Боровский Е.Э. «Вода на Земле», журнал «Химия в школе» №5, 2002
Дейнека Л.А., Габрук Н.Г., Манохина Л.А. – Методические указания. Рабочая тетрадь по аналитической химии – Белгород, 2001
Глинка Н.Л. Общая химия. М.,1986
Колчанова Л.В. Методические материалы к практическим работам. Белгород, 1994
Статистический сборник. Охрана окружающей среды в Белгородской области в 2009 году. E-mail: [email protected]
Web-cайт: https://belg.gks.ru
Приложение 1
Таблица 1. Объем воды в составляющих гидросферы
| Объем воды | ||
| Тыс. км3 | % от общего объема | |
| Мировой океан | 1370000 | 97,48 |
| Снежно — ледовые образования | 24400 | 1,74 |
| Подземные воды | 10500 | 0,75 |
| Малые составляющие |
|
|
| Озера | 230 | 0,016 |
| Болота | 100 | 0,007 |
| Почвенная влага | 75 | 0,005 |
| Атмосферная влага | 14 | 0,001 |
| Реки | 2 | 0,0001 |
| Вода в живых организмах | 1 | 0,00007 |
| Вся гидросфера | 1405322 | 100 |
Приложение 2
Таблица 2 Значение жесткости воды
| Не более 1,5 мэкв/л | |
| Мягкая | От 1,5 до 4 мэкв/л |
| Средняя жесткость | От 4 до 8 мэкв/л |
| Жесткая | От 8 до 12 мэкв/л |
| Очень жесткая | Больше 12 мэкв/л |
(миллионов кубических метров)
| 2005 | 2006 | 2007 | 2008 | 2009 | |
| Забор воды из природных | 376,4 | 358,1 | 325,1 | 323,4 | 313,3 |
| в том числе из подземных | 271,8 | 270,7 | 273,3 | 276,0 | 280,7 |
| Потери воды при транспортировке | 17,9 | 18,7 | 18,7 | 16,3 | 14,1 |
| Водопотребление (использование воды) – всего | 314,0 | 290,5 | 256,5 | 252,5 | 233,8 |
| из него на производственные нужды | 110,6 | 110,8 | 114,7 | 109,4 | 99,6 |
| Объем оборотного и последовательного использования | 1617,6 | 1626,1 | 1675,2 | 1533,2 | 1420,6 |
| в процентах от общего | 93,6 | 93,6 | 93,6 | 93,3 | 94,0 |
| Объем сброса нормативно-очищенных вод | 92,0 | 91,5 | 98,8 | 101,2 | 64,3 |
| Объем сброса загрязненных сточных вод (без очистки и | 10,7 | 10,5 | 7,8 | 11,1 | 48,9 |
Приложение 4. Пруд в с. Таврово
25
