Министерство образования Республики Башкортостан
ГБОУ СПО «Мелеузовский механико-технологический техникум»
Н.Ш. Зарипова
Ю.Н. Собянина
Электролиз.
Практическое применение электролиза
(методическая разработка бинарного урока)
Мелеуз
2013
Интегрированный урок по физике-химии.
Тема. Электролиз. Практическое применение электролиза.
Введение:
Учитель физики
В современном естествознании ведущее место принадлежит физике, поскольку она является теоретической основой технического прогресса.
Ядерная энергетика, ракетная и полупроводниковая техника, квантовые генераторы света – результат применения в технике достижений физики последних лет. От успешного развития физики зависит развитие многих взаимосвязанных с ней наук.
Учитель химии
Велико влияние физики на химию. Влияние физики проявилось в теории строения атома, в приложении термодинамики к химическим реакциям, в разработке теории электролитической диссоциации, в теории химической кинетики, которые положены в основу современной химии и содействуют ее дальнейшему развитию.
Учитель физики
О, физика – наука из наук!
Все впереди! Как мало за плечами!
Пусть химия нам будет вместо рук;
Пусть станет математика очами.
Учитель химии
Не разлучайте этих трех сестер
Познания всего в подлунном мире,
Тогда лишь будет ум и глаз остер,
И знание человеческое шире.
Учитель физики
Сегодня мы с вами проводим интегрированный урок, тема которого зашифрована в слове, состоящим из десяти букв.
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Чтобы отгадать слово вам предлагаются подсказки:
Под цифрой
1 — отрицательно заряженная частица, входящая в состав атома; (электрон)
2 –свечение веществ; (люминесценция)
3 – химический элемент -названный как одна из частей света ; (европий)
4 – положительно заряженный ион; (катион)
5 – раздел физики, изучающий соотношение превращения теплоты и других форм энергии (термодинамика);
6 – частица, несущая в себе неспаренный электрон; (радикал)
7 – единица измерения сопротивления ( Ом)
8 – одна из фракций, получаемая при перегонки нефти; (лигроин)
9 – разновидности атомов одного и того же химического элемента, которые отличаются атомной массой; (изотопы)
10 – продолжите поговорку « Слово-серебро, молчание — …»; (золото)
Итак, запишем тему урока «Электролиз. Практическое применение электролиза».
Цель урока:
1.Изучить качественные(химические) и количественные(физические) процессы, происходящие при электролизе;
2.Показать практическое применение электролиза.
Но прежде, я попрошу вас ответить на вопросы( проводится фронтальный опрос)
Фронтальный опрос:
1. Какие реакции называются окислительно-восстановительными ?
2.Какие вещества относятся к электролитам?
3. Приведите примеры веществ электролитов и неэлектролитов.
4.Что такое электрический ток?
5.Почему растворы и расплавы одних веществ проводят электрических ток, а других- нет?
6.Как называются положительно заряженные ионы?
7.Как называются отрицательно заряженные ионы?
Объяснение материала
Учитель химии
Дадим определение электролизу(Презентация):Электролизом называются окислительно-восстановительные реакции, которые протекают на электродах при пропускании электрического тока через расплав или раствор электролита.
Учитель физики
Посмотрим как происходит движение ионов при пропускании электрического тока через электролит( презентация)
Учитель химии
В промышленности металлы в зависимости от активности получают электролизом двух видов- электролизом расплавов и электролизом растворов.
1. Рассмотрим электролиз расплавов на примере электролиза поваренной
соли (NaCl).
Емкость,в которой происходит электролиз – электролитическая ванна
+ заряженная пластина-анод
_ заряженная пластина-катод.
Расплав поваренной соли содержит катионы Na+ и анионы Cl — . Если в электролитическую ванну, наполненную расплавом хлорида натрия опустить электроды, подсоединенные к источнику тока, то на катоде будут происходить восстановительные процессы и образуется металлический натрий, а на аноде – окислительные и выделится газообразный хлор.
Запишем катодные и анодные процессы:
— К: Na+ + 1e → Na0 2 окислитель, восстановление
+ А : 2Cl – — 2e → Cl20 1 восстановитель, окисление
Уравнение электролиза
2NaCl → 2Na + Cl2 ↑
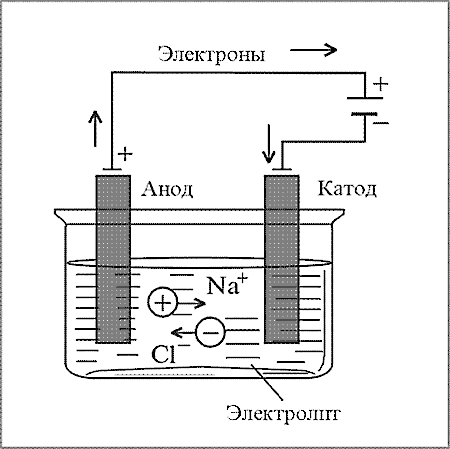
Таким образом, при электролизе расплавов солей на электродах образуются простые вещества, ионы которых входят в состав соли.
Электролиз растворов солей отличается от электролиза расплавов тем, что в окислительно — всстановительных процессах, кроме катионов металла и анионов кислотных остатков, участвует вода.
В электролизе расплавов солей нам поможет разобраться виртуальная лаборатория.
Занесем результаты эксперимента в таблицу:
| На катоде (-) | На аноде (+) | |
| CuCl2 |
|
|
| CuSO4 |
|
|
| KJ |
|
|
| Na2SO4 |
|
|
И попробуем разобраться в процессах
составив уравнения электролиза
1.Раствор CuCl2 содержит ионы: Сu2+; Cl— и воды Н+ ОН—
— К: Cu+2 + 2 е → Cu0 1 окислитель, восстановление
+ А: 2 Cl— — 2е → Cl20 ↑ 1 восстановитель, окисление
В электролизере остается вода
Уравнение электролиза: CuCl2 + H2O → Cu + Cl2↑ + H2O или
CuCl2 → Cu + Cl2↑
2.Раствор CuSO4 содержит ионы: Сu2+; SO42- и воды Н+ ОН—
— К: Cu+2 + 2 е → Cu0 2 окислитель, восстановление
+А: 4ОН— —4е → 2Н2О + О2↑ 1 восстановитель, окисление
В электролизере остаются ионы: SO42- и Н+
Уравнение электролиза: 2CuSO4+ 2H2O → 2Cu + О2↑ + 2H2SO4
3. Раствор KJ содержит ионы: K+ ; J— и воды Н+ ОН—
— К: 2Н+ + 2е → Н2↑ 1 окислитель, восстановление
+А: 2 J— — 2е → J2 1 восстановитель, окисление
В электролизере остаются ионы: K+ и ОН—
Уравнение электролиза: 2 KJ+ 2H2O → Н2↑ + J2 +2КОН
4. Раствор Na2SO4 содержит ионы: Na+; SO42- и воды Н+ ОН—
— К: 2Н+ + 2е → Н2↑ 2 окислитель, восстановление
+А: 4ОН— —4е → 2Н2О + О2↑ 1 восстановитель, окисление
В электролизере остаются ионы: Na+ и SO42- ;
Уравнение электролиза: Na2SO4 + 2H2O → 2Н2↑ + О2↑ + Na2SO4 или
2H2O → 2Н2↑ + О2↑
Сделаем выводы:
При электролизе водных растворов солей содержащих:
1. катионы активных металлов — на катоде выделяется Н2, поэтому в промышленности эти металлы получают только электролизом расплавов солей- в металлургии этот способ называется -электрометаллургия
2. катионы металлов средней и малой активности- на катоде выделяется металл, поэтому в промышленности эти металлы выгоднее получать электролизом растворов солей, данный способ называется -гидрометаллургия.
3. анионы бескислородных кислотных остатков – на аноде образуются простые вещества – неметаллы ( исключение ионы F—)
4. анионы кислородсодержащих кислотных остатков – на аноде выделяется кислород.
Мы изучили качественные процессы электролиза и ,прежде чем перейти к количественным, немного отдохнем.
Однажды великого мыслителя Сократа спросили о том, что, по его мнению, легче всего в жизни? Он ответил, что легче всего – поучать других, а труднее всего – познавать самого себя.
На уроках химии и физики мы говорим о познании природы. Но сегодня, прежде чем изучать физико-химические явления, давайте заглянем «в себя». Как мы воспринимаем окружающий мир? Как художники или как мыслители?
На уроке у нас присутствуют гости. Им тоже интересно заглянуть « в себя», да и узнать, к кому же они пришли в гости.
Проведем небольшой психологический тест
Переплетите пальцы рук.
Большой палец правой или левой руки оказался у вас вверху?
Результат запишите буквами «Л» или «П».
Скрестите руки на груди. («поза Наполеона»).
Какая рука сверху? Опять запишите результат.
Поаплодируйте.
Какая рука сверху? Результат запишите.
Подведем итоги:
Если ваш результат:
Содержит больше буквы «Л», то у вас более развито левое полушарие мозга и логическое мышление — вам соответствует художественный тип личности.
Содержит больше буквы «П», то у вас больше развито правое полущарие мозга и образное мышление – вам соответствует
Тип мыслителя.
Какой же тип мышления преобладает в вашей группе?
Поднимите руку, у кого получилось больше «Л», а теперь -у кого больше «П».
Учитель физики
Презентация: Объяснение законов Фарадея, решение задач
Презентация: Практическое применение электролиза:
Закрепление материала: физико-химическое лото.
Учитель химии
Скоро прозвенит звонок
И закончится урок
Мы надеемся друзья
Вы пришли сюда не зря
Оценить урок попросим
А вопросов будет восемь
Подчеркните вы чертой,
То,что связано с собой.
Студентам предлагается небольшая анкета, которая позволяет осуществить самоанализ, дать качественную характеристику уроку.
1.Уроком я: доволен недоволен
2. Урок мне показался коротким длинным
3. На уроке я: не устал устал
4.Тема мне понятна не понятна
5. На уроке я участвовал активно пассивно
6. материал оказался легким трудным
7.использование ТСО
усвоить тему помогло не помогло
8.На уроке мне было интересно не интересно
Домашнее задание: на доске
Приложение № 2
2.1 Схема: Электролиз расплава NaCl

Таблица: Электролиз растворов
| На катоде (-) | На аноде (+) | |
| CuCl2 |
|
|
| CuSO4 |
|
|
| KJ |
|
|
| Na2SO4 |
|
|
Приложение №3 Рефлексия
1.Уроком я доволен недоволен
2. Урок мне показался коротким длинным
3. На уроке я не устал устал
4.Тема мне понятна не понятна
5. На уроке я участвовал активно пассивно
6. материал оказался легким трудным
7.информационные
технологии усвоить тему помогло не помогло
8.На уроке мне было интересно не интересно
Список литературы
1. Учебник физики 11 кл. А.В. Перышкин. Москва «Дрофа» 2001;
2. Поурочные разработки по физике. Москва. «Вако» 2005г;
3. Диск Большая энциклопедия Кирилла и Мефодия. 2001г;
4. И.В. Савельева «Курс общей физики» т.1, М.: Наука, 1970.
5. Ю.М. Ерохин «Химия» — М.: Мастерство, 2002
6. Интернет-ресурсы.
