Химия 8 класс
Тема урока:
Кислоты: классификация, номенклатура, физические и химические свойства
«Всё познаётся в сравнении»
Цель урока:
– Обобщить и систематизировать знания о кислотах, их составе, классификации и химических свойствах.
Основные понятия: Кислоты, индикаторы.
Планируемые результаты обучения.
– Знать состав кислот и их классификацию.
– Уметь определять валентность кислотного остатка и составлять формулы кислот.
– Знать химические свойства кислот.
– Уметь составлять уравнения химических реакций, распознавать кислоты с помощью индикаторов.
– Знать правила техники безопасности при работе с кислотами.
Демонстрации:
– Действие растворов кислот на индикаторы (фенолфталеин, лакмус, метиловый оранжевый), взаимодействие кислот с металлами.
Оборудование: лабораторная посуда (пробирки, штатив для пробирок), набор индикаторов (универсальный, фенолфталеин, лакмус, метиловый оранжевый), растворы кислот, гранулы цинка, раствор хлорида бария, раствор гидроксида натрия.
Тип урока: комбинированный.
Обозначения:
— запись в рабочих листах;
— запись на доске;
ХОД УРОКА
1. Организационный момент
Учитель: Здравствуйте! Присаживайтесь!
2. Актуализация знаний и проверка д/з
Учитель: Каждый находящийся в классе ученик 8 класса не может заявить, что он все знает. В правоте этих слов мы сегодня с вами убедимся. Девизом нашего урока пусть будет высказывание великого мыслителя П. Лапласа:
То, что мы знаем – ограничено;
То, что не знаем – бесконечно
Учитель: Мы продолжаем изучать основные классы неорганических соединений. Что же мы с вами уже знаем? Нам известен класс оксиды и класс основания. Дайте определение этих классов веществ.
Ответ учащегося: Оксид – это сложное вещество, которое состоит из двух элементов, одним из которых является кислород.
Ответ учащегося: Основание – это сложное вещество, в состав которого входит атом металла, соединенный с одной или несколькими гидроксогруппами ОН.
Учитель: на магнитной доске прикреплены карточки с формулами веществ. Сидящие на 1 варианте выбирают формулы оксидов и дают их название. Учащиеся 2 варианта выбирают формулы оснований и также называют их.
2 ученика работают у доски.
Все остальные выполняют работу в рабочих тетрадях.
| HCl | Ca(OH)2 | K2O | CuOH | Fe2O3 | HNO3 | |
| H2CO3 | CaO | Fe(OH)2 | Al(OH)3 | H2SO4 | H3PO4 | H2SiO3 |
Ответ учащегося:
1. Na2O – оксид натрия,
K2O – оксид калия,
Fe2O3 – оксид железа (III),
CaO – оксид кальция
2. Ca(OH)2 – гидроксид кальция,
CuOH – гидроксид меди (I),
Fe(OH)2 – гидроксид железа (II),
Al(OH)3 – гидроксид алюминия (III).
Учитель: Молодцы. Справились с заданием. Посмотрите на оставшиеся карточки. Что общего у этих веществ?
Ответ учащегося: Все оставшиеся вещества начинаются с атома водорода.
Учитель: Правильно. Это сложные вещества. Они состоят из атомов водорода, который может замещаться на атом металла и кислотных остатков. Такие вещества называются кислотами.
3. Изучение новой темы
Учитель: Итак, давайте запишем определения кислот в ваши рабочие листы (приложение 1)
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
Учитель: Общая формула кислот

Для составления формул полученных веществ важно знать, что валентность кислотного остатка определяется числом атомов водорода в кислоте, способных замещаться атомами металлов.
Кислотный остаток в химической реакции сохраняется и переходит из одного соединения в другое.
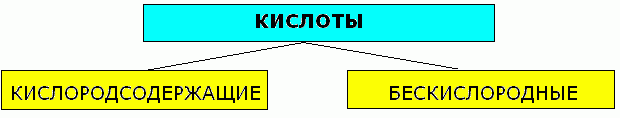
Учитель: 1. По составу кислоты делятся на бескислородные и кислородсодержащие.
2. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
Учитель: в рабочих листах ( приложение 1) у вас представлены таблицы с примерами кислоты, они с пробелами, давайте их заполним.
Ответ учащихся:
а) Таблица кислород содержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
| Кислотный остаток (А) | Соответствующий кислотный оксид | |
| HClO4 хлорная | ClO4 (I) перхлорат | Cl2O7 оксид хлора (VII ) |
| H2SO4 серная | SO4 (II) сульфат | SO3 оксид серы (VI ), серный ангидрид |
| HNO3 азотная | NO3 (I) нитрат | N2O5 оксид азота ( V ) |
| HMnO4 марганцевая | MnO4 (I)перманганат | Mn2O7 оксид марганца (VII ) |
| H2SO3 сернистая | SO3 (II) сульфит | SO2 оксид серы (IV ) |
| H3PO4ортофосфорная | PO4 (III) ортофосфат | P2O5 оксид фосфора (V ) |
| HNO2 азотистая | NO2 (I) нитрит | N2O3 оксид азота (III ) |
| H2CO3 угольная | CO3 (II) карбонат | CO2 оксид углерода ( IV), углекислый газ |
| H2SiO3 кремниевая | SiO3 (II) силикат | SiO2 оксид кремния (IV) |
б) Таблица бескислородных кислот
| Кислотный остаток (А) | |
| HCl соляная, хлороводородная | Cl (I) хлорид |
| H2S сероводородная | S(II) сульфид |
| HBr бромоводородная | Br (I) бромид |
| HI йодоводородная | I(I) йодид |
| HF фтороводородная,плавиковая | F(I) фторид |
Учитель: Молодцы, справились с заданием.
Кислоты – вещества, которые обладают определёнными физическими свойствами.
Посмотрите на образцы кислот на демонстрационном столе, определите их свойства.
Ответ учащегося: Все кислоты жидкие, не имеют цвета.
Учитель: Вы правы. Все кислоты жидкие. Но известны и твердые кислоты: фосфорная, метафосфорная, борная. Почти все растворимы в воде. Нерастворима кремниевая кислота H2SiO3. Кислоты используют в домашнем хозяйстве. Вы знаете что уксусная, лимонная кислоты кислые на вкус. Каждый пробовал эти кислоты, т.к. они пищевые и имеются в каждом доме на кухне. Но не все кислоты можно пробовать, т.к. многие из них ядовиты. А как же получают кислоты? Давайте познакомимся с получением кислот и заполним таблицу (приложение 1), опираясь на схему в учебнике.
Ответ учащихся:
Способы получения кислот
| кислородсодержащие | |
| HCl, HBr, HI, HF, H2S | HNO3, H2SO4 и другие |
| ПОЛУЧЕНИЕ | |
| 1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl | 1. Кислотный оксид + вода = кислота SO3 + H2O = H2SO4 |
| 2. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl | |
Учитель: Все справились с заданием? Молодцы.
А теперь мы познакомимся с химическими свойствами кислот. Каждый из вас получил памятку по ТБ при работе с кислотами. Ознакомьтесь с ее положениями.
Вы уже знаете что является индикаторами, давайте повторим.
Ответ учащегося: Вещества, под действием которых растворы кислот и щелочей меняют свой цвет, называют индикаторами.
Учитель: Итак, водные растворы кислот реагируют с индикаторами. Дайте определение, как же меняют индикаторы свой цвет в кислой среде, и на основание этого заполним таблицу в ваших рабочих листах (приложение 1)
Проведение опытов на рабочих местах

Ответ учащегося:
| Нейтральная среда | Кислая среда | |
| Лакмус | Фиолетовый | Красный |
| Фенолфталеин | Бесцветный | Бесцветный |
| Метилоранж | Оранжевый | Красный |
| Универсальная индикаторная бумага | Оранжевая | Красная |
Учитель: Однажды английский химик Р. Бойль, изучая свойства соляной кислоты, закупленной в Германии у И. Глаубера, случайно пролил ее. Кислота попала на сине-фиолетовые лепестки фиалок. Спустя некоторое время лепестки стали ярко-красными. Это явление удивило Р. Бойля, и он тут же провел серию опытов с разными кислотами и цветкам разных растений. Оказалось, что и васильки, и розы, и цветки некоторых других растений изменяли свою окраску при действии кислот. После некоторых раздумий такие вещества Р. Бойль назвал индикаторами, что в переводе с латинского означало «указатели». Эти вещества затем стали использовать многие химики в опытах для распознавания кислот.
Учитель: У вас на партах лежат карточки с номером группы и описание химических опытов (приложение 2). Кто справился с определением среды индикаторами может приступать к изучению химических свойств опытным путем, не забывая при этом о правилах техники безопасности.
Группы между собой обмениваются результатами и выводами, уравнения записывают на доске.
Ответы учащихся:
1 группа Реакция обмена. Изменение цвета из прозрачного в малиновый и снова в прозрачный.
NaOH+HCl= NaCl +H2O
Вывод: кислоты реагируют с основаниями.
2 группа Реакция обмена, выпал белый осадок.
H2SO4+BaCl2=BaSO4+2HCl
Вывод: кислоты реагируют с солями
3 группа реакция замещения. Выделение пузырьков газа.
Zn +2HCl= ZnCl2+H2
Вывод: кислоты реагируют с металлами.
Учитель: Молодцы, все группы справились с заданием.
Итак, что мы узнали на уроке?
Ответ учащихся:
Что такое кислоты.
Классификацию кислот
Как составляются формулы кислот и их названия.
Физические и химические свойства кислот.
4 Закрепление
Учитель: У вас в рабочих листах ( приложение 1) есть тестовые задания, выполните их.
Ответ учащегося:
1) Игра «Третий лишний»
В каждом ряду найдите лишнюю формулу, ответ мотивируйте:
| H2SO4 | H3PO4 | |
| H2SO3 | H2SiO3 | H3PO4 |
бескислородная кислота.
3х основная кислота.
2) Ребята решили укомплектовать свою учебную лабораторию оксидами, основаниями и кислотами. Заказ им прислали по почте в виде двух посылок:
1-я посылка: NaOH, CaO, H3PO4, HNO3, Ca(OH)2, Cr2O3;
2-я посылка: FeO, H2SO4, KOH, Fe(OH)2, P2O5, HCl.
Но названия веществ подписать забыли. Помогите ребятам.
1я посылка NaOH – гидроксид натрия, CaO- оксид кальция, H3PO4— ортофосфорная кислота, HNO3 – азотная кислота, Ca(OH)2 – гидроксид кальция, Cr2O3 – оксид хрома (III);
2я посылка FeO – оксид железа, H2SO4 – серная кислота, KOH – гидроксид калия, Fe(OH)2 – гидроксид железа (II), P2O5 – оксид фосфора, HCl – хлороводород или соляная кислота.
3) Даны кислотные остатки:
F¯ ; ClO4¯ ; SiO3²¯.
Составьте формулы возможных кислот, назовите их.
HF – фтороводород, плавиковая кислота
HClO4 – хлорная кислота
H2SiO3– кремневая кислота.
Учитель: Кто не успел, закончите дома.
5. Домашнее задание
§ 32, упр. 5–9 (с. 104–105), задачи 1–4 (с. 105).
6. Рефлексия
Учитель: Закончите предложения:
Ответ учащихся:
сегодня я узнал…
было интересно…
было трудно…
я выполнял задания…
я понял, что…
теперь я могу…
я почувствовал, что…
я приобрел…
я научился…
у меня получилось …
я смог…
я попробую…
меня удивило…
урок дал мне для жизни…
мне захотелось…
7. Итог урока
Учитель: Всем спасибо за урок. До свидания.
Приложение 1
Рабочий лист урока
Тема: Кислоты: классификация, номенклатура,
физические и химические свойства
1. Запишите определение :
Кислоты–___________________________________________________________
__________________________________________________________________
Кислотный остаток — _________________________________________________ __________________________________________________________________
2. Общая формула кислот:
3. Допиши схему:
![]()
4. Заполни пропуски в таблицах
Кислородные
| Кислотный остаток (А) | Соответствующий кислотный оксид | |
| HClO4 хлорная |
| Cl2O7 оксид хлора (VII ) |
|
| SO4 (II) сульфат | SO3 оксид серы (VI ), серный ангидрид |
| HNO3 азотная |
|
|
|
| MnO4 (I)перманганат | Mn2O7 оксид марганца (VII ) |
| H2SO3 сернистая |
|
|
| H3PO4ортофосфорная |
|
|
| HNO2 азотистая |
| N2O3 оксид азота (III ) |
| H2CO3 угольная |
|
|
|
| SiO3 (II) силикат |
|
Бескислородные
| Кислотный остаток (А) | |
| HCl соляная, хлороводородная |
|
|
| S(II) сульфид |
| HBr бромоводородная |
|
|
| I(I) йодид |
| HF фтороводородная,плавиковая |
|
5. На основание схемы учебника заполни пропуски в схеме
Способы получения кислот
| Кислородсодержащие | |
| 1. Прямое взаимодействие неметаллов
| 1. Кислотный оксид + вода = кислота
|
| 2. Реакция обмена между солью и менее летучей кислотой
| |
6. Проведи опыты с индикаторами и растворами кислот. Заполни таблицу:
Химические свойства кислот
| Нейтральная среда | Кислая среда | |
| Лакмус | Фиолетовый |
|
| Фенолфталеин | Бесцветный |
|
| Метилоранж | Оранжевый |
|
| Универсальная индикаторная бумага | Оранжевая |
|
7. Химические опыты
1)
2)
3)
8. Выполни задания
1) Игра «Третий лишний»
В каждом ряду найдите лишнюю формулу, ответ мотивируйте:
| H2SO4 | H3PO4 | |
| H2SO3 | H2SiO3 | H3PO4 |
2) Ребята решили укомплектовать свою учебную лабораторию оксидами, основаниями и кислотами. Заказ им прислали по почте в виде двух посылок:
1-я посылка: NaOH, CaO, H3PO4, HNO3, Ca(OH)2, Cr2O3;
2-я посылка: FeO, H2SO4, KOH, Fe(OH)2, P2O5, HCl.
Но названия веществ подписать забыли. Помогите ребятам.
3) Даны кислотные остатки:
F¯ ; ClO4¯ ; SiO3²¯.
Составьте формулы возможных кислот, назовите их.
9. Закончите предложения:
сегодня я узнал…
было интересно…
было трудно…
я выполнял задания…
Приложение 2
