ГБОУ СОШ с. Новотулки
План-конспект урока химии в 9 классе
«Алюминий»
Выполнила учитель химии
Вдовина С. Ю.
2014 год
Цель урока: опираясь на имеющиеся у учащихся знания продолжить изучение металлов
Задачи:
образовательные: познакомить учащихся со строением атома алюминия, на основе строения атома выявить закономерности химических свойств металла, закрепить на практике с понятие «амфотерность» и «пассивация»; совместно с учащимися определить взаимозависимость между физическими свойствами и областями применения алюминия; рассмотреть способ получения данного металла.
развивающие: продолжить формировать умение на основе частных примеров делать умозаключения, выявлять закономерности и зависимость между строением атома и свойствами простого вещества, между свойствами и применением; развивать у детей умение работать с реактивами и химическим оборудованием.
воспитательная: активизировать познавательный интерес и творческую активность каждого школьника.
Урок изучения нового материала.
Методы обучения: словесные, решение задач, практический.
Оборудование и материалы:
На столах: алюминиевые ложки, фольга от шоколада, банка из-под кофе, кусочки провода, тюбики с кремом и зубной пастой, модель детской игрушки- самолета.
Реактивы: раствор соляной кислоты (HCl), раствор гидроксида натрия (NaOH), кусочки алюминия.
Оборудование: пробирки, алюминиевая проволока, наждачная бумага, фильтровальная бумага, химический стакан с водой.
Для демонстрации: концентрированная серная кислота, раствор серной кислоты, раствор гидроксида натрия, кусочки алюминия. Схема «электролиз боксита»
Ход урока.
Орг момент.
Постановка цели урока: сегодня мы познакомимся с металлом, из которого сделаны вещи, лежащие перед вами. Кто же этот «мистер Х»?
Предполагаемый ответ: алюминий
Учитель: Название алюминий происходит от латинского слова «алюмен» — квасцы. Эту соль люди начали использовать задолго до нашей эры. Сначала в качестве протравы для окрашивания тканей, потом в медицинских целях в качестве кровоостанавливающего средства. Описание этого вещества есть и у Плиния Старшего, и у Геродота – самых авторитетных древних историков. Среди русских химиков XIX века бытовало название «глиноземий».
3. Изучение нового материала
| Деятельность учащихся | |
| Задача. Используя ПСХЭ, укажите «адрес»алюминия. | Используя таблицу, называют период, группу, подгруппу, порядковый номер |
| Постановка задачи: покажите строение атома алюминия, составьте электронную формулу и выясните какое число валентных связей может образовать атом алюминия | Составляют схему строения и отвечают на вопрос |
| Задача1: составьте формулы соединений алюминия:оксида, хлорида, карбида, гидроксида. Определите степень окисления алюминия в них. Задача2: сравните строение атома и катиона алюминия. | Выполняют задачу, учитель контролирует |
| Задача: давайте сравним восстановительные свойства алюминия и родоначальника IIIА группы — бора и объясним характер изменения этих свойств. | Участвуют в беседе с учителем |
| Задача: давайте попробуем описать физические свойства алюминия, используя прилагательные. Чем обусловлены характерные физические свойства алюминия? | Предлагают ответ: серебристо-белый, легкий, легкоплавкий, пластичный…
|
| Беседа:Как вы думаете, какова активность алюминия? Предполагаемый ответ: так как в э х ряду напряжения алюминий находится сразу после щелочных и щелочно – земельных металлов, он должен обладать высокой химической активностью. Задача: Что мы наблюдаем на практике? Как же тогда из алюминия делают кухонную посуду, провода и т.д.? На практике мы наблюдаем, что алюминий широко используется, но при этом не изменяется, то есть, является устойчивым к внешним воздействиям. Какова причина данного явления? | Работают с учебником. Предполагаемый ответ: защищен оксидной пленкой |
| Задача: составьте уравнение реакции горения алюминия. Где мы можем наблюдать подобную реакцию? Чем является алюминий в этой реакции(окислитель или восстановитель)? | Учащиеся составляют реакцию, учитель помогает отвеить на вопрос |
| Задача: что мы будем наблюдать, если зачищенную наждачной бумагой алюминиевую проволоку поместить в стакан с подогретой водой? Составьте уравнение реакции. | П 2AL+6H2O = 2 AL(OH)3+3H2 |
| Вы знаете, что металлы реагируют с неметаллами. Задача: составьте уравнения реакций по схеме: A
Al4C3 Расставьте коэффициенты методом электронного баланса. Укажите чем является алюминий в этих реакциях. Сделайте вывод. |
Выполняют задачу |
| Учитель: Продолжим наше исследование химических свойств алюминия. Качественно-экспериментальная задача «взаимодействие алюминия с растворами кислот и щелочей» В две пробирки налить 2-3 мл растворов соляной кислоты и гидроксида натрия. Опустить в каждую из пробирок по кусочку алюминия. Следить за протеканием реакции. Вопрос: Как вы думаете, какой газ выделяется в обоих случаях? Сделайте вывод о свойствах алюминия. Алюминий – элемент амфотерный. Поэтому он реагирует и с кислотами, и со щелочами, выделяя водород и превращаясь в соли. |
Под руководством учителя проводят лабораторный опыт, наблюдают за результатом, формулируют вывод.
Под руководством учителя составляют уравнения реакций. |
| Задача: а все ли кислоты взаимодействуют с алюминием? Давайте посмотрим как ведет себя алюминий с разбавленными и концентрированными кислотами. Учитель проводит демонстрационный опыт. В две пробирки налить 2-3 мл серной (к) и (р) кислоты и опустить в каждую пробирку по кусочку алюминия. Что мы наблюдаем? Как вы можете это объяснить? Учитель дополняет, что пассивируют алюминий азотная(к) и серная (к) кислоты. Поэтому их перевозят в алюминиевых цистернах. | Наблюдают, рассуждают, формулируют умозаключения. Составляют уравнения реакций. |
| Вы наверно знаете, что человек использует алюминий в металлургии для получения металлов. Задача: как называется такой способ ? Составьте уравнения реакций получения железа из Fe3O4; ванадия из V2O5; титана из TiO2 | Работают с текстом учебника и составляют уравнения реакций по образцу. |
| Учитель, используя географическую карту выясняет вместе с ребятами, что месторождения алюминиевых руд, электростанции и металлургические заводы сконцентрированы вместе. Например,Сибирь: Аченск, Братск, Красноярск, Саяногорск. Задача: Почему заводы по производству алюминия из природных руд строят вблизи электростанций? Как получают алюминий? Что используют в качестве сырья? Какие экологические проблемы могут возникать в местах производства? | Используя текст учебника решают задачу. При необходимости учитель конкретизирует, поясняет. |
| Учитель: алюминий второй по значению металл. Составьте схему «Применение алюминия». Прокоментируйте свою схему, опираясь на свойства алюминия. | Составляют схему и комментируют ее. |
Закрепление: Исправьте ошибки в тексте.
В XIX веке алюминий считался полудрагоценным металлом, хотя это и самый распространенный на земле металл. Высокая цена алюминия была связана с трудностью его восстановления до металлического состояния.
Алюминий покрыт оксидной пленкой, которая предохраняет его от внешнего воздействия.
На воздухе при обычных условиях без защитной пленки алюминий окисляется до оксида.
В растворе хлорида меди алюминий вытесняет металлическую медь и является окислителем.
Алюминий вступает в реакции с: оксидом серы, оксидом хрома, водой, йодом.
В алюминиевой посуде нельзя хранить квашеную капусту, маринованные овощи и кислое молоко. К тому же такую посуду нельзя мыть щелочными средствами, например, содой.
Боксит, глинозем, корунд можно выразить одной формулой.
Домашнее задание: стр. 68-71
решите задачу: сколько оксида железа должно быть восстановлено алюминием, чтобы получить железо: а) 112 г., б) 5 моль?
ЭЛЕМЕНТЫ ЗНАНИЙ ПО ТЕМЕ «АЛЮМИНИЙ»
1. положение алюминия в ПСХЭ
2. строение атома алюминия
3. число валентных связей и степень окисления алюминия
4.физические свойства
5.химическая активность алюминия
6. химические свойства. горение алюминия.
7.химические свойства. Реакция алюминия с водой
8. химические свойства. Реакция алюминия с неметаллами
9. амфотерность алюминия
10. реакции алюминия с кислотами. Пассивация.
11. алюмотермия
12. получение алюминия из природного сырья
13. применение алюминия
14. нахождение оксида алюминия в природе
15.физические свойства оксида алюминия
16. химические свойства оксида алюминия
17. способы получения гидроксида алюминия
18. химические свойства гидроксида алюминия
19. генетическая связь алюминия и его соединений
20. качественная реакция на катион алюминия
Подбор задач
Качественные — 22
Количественные — 7
Качественно-экспериментальные — 5
Количественно-экспериментальные — 1
Качественные задачи
1.Используя ПСХЭ, опишите «адрес» алюминия
2. покажите строение атома алюминия, составьте электронную формулу и выясните какое число валентных связей может образовать атом алюминия
3.составьте формулы соединений алюминия:оксида, хлорида, карбида, гидроксида. Определите степень окисления алюминия в них.
Сравните строение атома и катиона алюминия.
4. Сравните восстановительные свойства алюминия и родоначальника IIIА группы — бора и объясним характер изменения этих свойств.
5. Опишите физические свойства алюминия, используя прилагательные.
Чем объясняются характерные физические свойства алюминия?
6. На практике мы наблюдаем, что алюминий широко используется (например для изготовления кастрюль, электропроводов), но при этом не изменяется, то есть устойчив к внешним воздействиям. Какова причина данного явления?
7. Составьте уравнение реакции горения алюминия. Где мы можем наблюдать подобную реакцию? Чем является алюминий в этой реакции(окислитель или восстановитель)?
8. Что мы будем наблюдать, если зачищенную наждачной бумагой алюминиевую проволоку поместить в стакан с подогретой водой? Составьте уравнение реакции.
9.Составьте уравнения реакций по схеме:
A
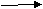 l2S3 Al AlCl3
l2S3 Al AlCl3
Al4C3
Расставьте коэффициенты методом электронного баланса. Укажите чем является алюминий в этих реакциях. Сделайте вывод.
10. Какой газ выделяется, если кусочки алюминия поместить в раствор кислоты, и в раствор щелочи? Сделайте вывод о свойствах алюминия.
11. Что вы будете наблюдать, если в две пробирки налить 2 мл серной (конц) и 2 мл серной кислоты (разб) и опустить в каждую пробирку по кусочку алюминия. Как вы можете это объяснить?
12. Как называется способ получения металлов с помощью алюминия ?
Составьте уравнения реакций получения железа из Fe3O4; ванадия из V2O5; титана из TiO2
13. используя текст учебника, составьте таблицу
| Особенности | Применение | |
|
|
|
|
14. Почему заводы по производству алюминия из природных руд строят вблизи электростанций? 3.Как получают алюминий? Что используют в качестве сырья?какие экологические проблемы связаны с производством алюминия?
15. Составьте схему «Применение алюминия». Прокоментируйте свою схему, опираясь на физические свойства алюминия.
16. Предложите несколько способов получения оксида алюминия.
17. Встречаем ли мы в природе оксид алюминия? Опишите его физические свойства.
Имеет ли оксид алюминия практическое значение?
18. Что такое амфотерность и как она проявляется у оксида алюминия? Приведите уравнения реакций.
19. Каким из известных вам способов можно получить гидроксид алюминия? Составьте уравнение реакции. Объясните почему не подошли другие способы.
20. Одинаков ли будет результат у двух учеников, проводящих опыт с одними и теми же веществами, если первый ученик приливает гидроксид калия к хлориду алюминия, а второй- хлорид алюминия к гидроксиду калия? Объясните результат.
21.Н
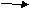
 апишите уравнения реакций следующих превращений: AL ALCL3 AL(OH)3 A
апишите уравнения реакций следующих превращений: AL ALCL3 AL(OH)3 A
 L2O3 ALCL3 Na[AL(OH)4]
L2O3 ALCL3 Na[AL(OH)4]
Первую реакцию рассмотрите как окислительно-восстановительный процесс. Реакции, идущие с участием электролитов, запишите в ионной форме.
В двух пробирках находятся соли: хлорид алюминия и хлорид натрия. Предложите способ как их можно различить.
Количественные задачи
На весах взвесили 135 г алюминиевой стружки. Сколько молекул во взвешенной навеске.
Сколько оксида железа должно быть восстановлено алюминием, чтобы получить железо: а) 112 г., б) 5 моль?
Какую массу алюминия можно выплавить из 500 кг глинозема, содержащего 4% примесей?
Какой объем хлора вступит в реакцию с 54 г алюминия и сколько соли образуется, если выход составляет 96 %?
Смесь алюминия и меди массой 1,87 г обработали избытком соляной кислоты и получили при этом 33,6 мл газа. Определите состав смеси в %.
Получится ли алюминат натрия при действии 50 г щелочи и 15 г сульфата алюминия? Если да, то сколько?
Какую массу осадка можно получить, если 200 г 10% раствора хлорида алюминия обработали 20 г 10% раствора гидроксида натрия?
Качественно-экспериментальные задачи
Докажите опытным путем, что алюминий может взаимодействовать с хлоридом меди.
Получите, экспериментально, из хлорида алюминия оксид алюминия.
Вам выдано 2 оксида: оксид кальция и оксид алюминия. Определите, где какой оксид.
Получите реакцией обмена гидроксид алюминия и экспериментально докажите его амфотерность.
В склянках без этикеток находятся кристаллические соли: хлорид алюминия и натрия. Опытным путем узнайте, где какая соль.
Количественно-экспериментальные задачи
Осуществите практически реакции взаимодействия алюминия с серной кислотой и соляной кислотой. Расчитайте какое количество каждой кислоты будет израсходовано для реакции с 3 г алюминия.
