
















 Урок №68.
Урок №68.
Тема урока: Основания, их классификация и свойства.
Л.р.№15 «Химические свойства оснований».
Цели и задачи урока:
Углубить знания учащихся об основаниях;
Повторить классификацию оснований;
Разобрать типичные реакции класса оснований.
Оборудование: таблица химических элементов Д.И.Менделеева, видеофрагмент «Химические свойства оснований», лабораторное оборудование для лабораторной работы.
Ход урока:
Организационный момент.
Проверка д/з:
Уравнения реакций соляной кислоты с веществами.
Основная часть:
Определение
Классификация оснований – стр. 215 Таблица 11 учебника.
Основания
растворимые нерастворимые
(щелочи)
NaOH, KOH, Ва(ОН)2 Cu(OH)2, Fe(OH)3
Основания
однокислотные двухкислотные трехкислотные
NaOH Ва(ОН)2 Fe(OH)3
Л.р.№15 «Химические свойства оснований».
Памятку в тетрадь !!!
С кислотами — в пробирку с щелочью добавляется ф-ф, кислоту добавляют до исчезновения окраски
2NaOH + H2SO4 = Na2SO4 + 2H2O
2Na+ + 2OH— + 2H+ + SO42- = 2Na+ + SO42- + 2H2O
OH— + H+ = H2O
Реакция нейтрализации.
С кислотными оксидами — в пробирку с щелочью добавляется ф-ф, СО2 вдувают до исчезновения окраски
2NaOH + СО2 = Na2СО3 + H2O
2Na+ + 2OH— + СО2 = 2Na+ + СО32- + H2O
2OH— + СО2 = СО32- + H2O
С солями (если ↑ или ↓)
3NaOH + FeCl3 = 3NaCl + Fe(ОН)3↓
3Na+ + 3OH— + Fe3+ + 3Cl— = 3Na+ + 3Cl— + Fe(ОН)3↓
3OH— + Fe3+ = Fe(ОН)3↓
гидроксид железа(III)
NН3↑
NaOH +NН4Cl = NaCl + NН4OH
H2O
Na+ + OH— + NН4+ + Cl— = Na+ + Cl— + NН3↑ + H2O
OH— + NН4+ = NН3↑ + H2O
Закрепление: просмотр видеофрагмента «Химические свойства оснований»;
выполнение упр. 3 стр. 217
а) P2O5 + 6KOH = 2K3PO4 + 3H2O
P2O5 + 6K+ + 6OH— = 6K+ + 2PO43- + 3H2O
P2O5 + 6OH— = 2PO43- + 3H2O
б) Fe(ОН)2 + 2HNO3 = Fe(NO3)2 + 2H2O
Fe(ОН)2 + 2H+ + 2NO3— = Fe2+ + 2NO3— + 2H2O
Fe(ОН)2 + 2H+ = Fe2+ + 2H2O
2NН3↑
в) (NН4)2SO4 + 2NaOH = Na2SO4 + 2NН4OH
2H2O
2NН4+ + SO42- + 2Na+ + 2OH— = 2Na+ + SO42- + 2NH3↑ + 2H2O
2NН4+ + 2OH— = 2NH3↑ + 2H2O
NН4+ + OH— = NH3↑ + H2O
аммиак
г) Ca(OH)2 + CO2 = CaCO3 + H2O
карбонат кальция
д) 3Ba(OH)2 + 2Fe(NO3)3 = 3Ba(NO3)2 + 2Fe(OH)3↓
3Ba2+ + 6OH— + 2Fe3+ + 6NO3— = 3Ba2+ + 6NO3— + 2Fe(OH)3↓
6OH— + 2Fe3+ = 2Fe(OH)3↓
3OH— + Fe3+ = Fe(OH)3↓
гидроксид железа(III)
е) KOH + NaNO3 → нет ↑ или ↓
ж) Mg(OH)2 + FeO → основания с основными оксидами не взаимодействуют
з) 2CuOH = Cu2O + H2O
оксид меди (I)
Д/з: § 39 ; упр. 3,4,5 стр. 217-218
Упр. 4
Дано: Решение:
m(NН4 NO3) = 890 г 712 г m V
ώпр = 20% NН4 NO3 + NaOH = NaNO3 + NН3↑ + H2O
ώ(NaOH) = 80% М = 80 г/моль 40 г/моль 22,4 л
m = 80 г 40 г
V (NH3) — ?
mр-ра (NaOH) — ?
Расчет на примеси:
890 г – 100%
m пр — 20 % m пр = 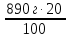 = 178 г (примесей)
= 178 г (примесей)
m (NН4 NO3) = 890 г – 178 г = 712 г
М(NН4 NO3) = 14 + 1 · 4 + 14 + 16 · 3 = 80 г/моль
m(NН4 NO3) = 1 моль · 80 г/моль = 80 г
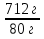 =
= 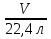 V =
V = 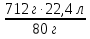 = 199 л (NH3)
= 199 л (NH3)
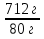 =
= 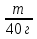 V =
V =  = 356 г (NaOH)
= 356 г (NaOH)
mр-ра = 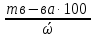 =
= 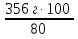 = 445 г (NaOH)
= 445 г (NaOH)
Ответ: V (NH3) = 199 л; mр-ра (NaOH) = 445 г
