Урок 21
Азотная кислота и ее соли. Окислительные свойства азотной кислоты
Цели урока:
1. Охарактеризовать азотную кислоту по следующей схеме: физические и химические свойства разбавленной и концентрированной азотной кислоты, применение. Познакомить с качественной реакцией на нитрат-ион. Охарактеризовать соли азотной кислоты (предметный результат).
2. Продолжить развивать умение генерировать идеи, выявлять причинно-следственные связи, искать аналогии и работать в команде, пользоваться альтернативными источниками информации (метапредметный результат).
3. Формирование умений управлять своей учебной деятельностью, подготовка к осознанию выбора дальнейшей образовательной траектории (личностный результат).
Ход урока
Подготовка к восприятию нового материала (10 мин)
Опрос учащихся по домашнему заданию.
Изучение нового материала (20 мин)
Строение молекулы азотной кислоты: ![]()
Получение:
В лаборатории азотную кислоту получают действием конц. серной к-ты на нитраты.
![]()
В пром-ти получают окислением аммиака кислородом воздуха в присутствии катализатора.
Физ. свойства: бесцветная дымящаяся жидкость с резким раздражающим запахом. Конц. азотная к-та желтого цвета из-за частичного разложения до оксида азота (IV).
Химические свойства:
1. Диссоциация в водном растворе:
HNO3 = H+ + NO3—
2. Вз-е с основными оксидами:
HNO3 + СuO = Cu(NO3)2 + H2O
3. Вз-е с основаниями:
HNO3 + Fe(OH)2 = Fe(NO3)2 + H2O
4. Вз-е с солями более слабых и более летучих кислот:
HNO3 + Na2CO3 = NaNO3 + H2O + CO2
5. Разложение при нагревании и/или на свету:
4 HNO3 = 2H2O + 4NO2 + O2
6. Вз-е с металлами:
| Основной продукт восстановления | |
| Концентрированная кислота | |
| Щелочные, щелочно-земельные, Мg, Zn и др. активные металлы | N2O или N2 |
| Cu, Ag, Pb и др. малоактивные металлы | NO2 |
| Fe, Al, Cr | Не реагируют |
| Разбавленная кислота | |
| Щелочные, щелочно-земельные, Мg, Zn и др. активные металлы | NH3 или NH4NO3 |
| Cu, Ag, Pb и др. малоактивные металлы | NO |
Качественная реакция на нитрат-ион:
Взаимодействие нитрат-иона с медной стружкой и концентрированной серной кислотой при нагревании. Выделяется газ бурого цвета.
![]()
Соли азотной кислоты
Твердые кристаллические вещества. Хорошо растворимы в воде.
При нагревании нитраты разлагаются с выделением кислорода:
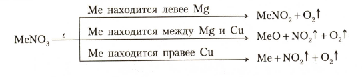
Закрепление нового материала (15 мин)
Решение задач по: Рябов Сборник задач и упражнений по химии. 9 класс. С.73.
Домашнее задание: §19, §20, с.59 №4, №6, задача 1, 3.
