МОУ Судиславская средняя общеобразовательная школа
Судиславского муниципального района Костромской области
«Фенол»
Учитель химии первой квалификационной категории
Кабанова Наталия Николаевна
п.Судиславль, 2011
Предмет: химия
Класс: 10
Тема урока: Фенол
Цель урока – сформировать понятие о фенолах как самостоятельном классе кислородсодержащих органических веществ в процессе исследовательской деятельности на основе сравнения со спиртами, развить понятия о взаимном влиянии атомов, зависимости применения от свойств вещества.
Задачи:
обучающие – формирование представлений о простейшем одноатомном феноле (отличие его от спиртов), ознакомление со способами получения фенола, его физическими и химическими свойствами, зависимости свойств от взаимного влияния атомов в молекуле, распознаванием и применением фенола;
развивающие–способствовать формированию познавательной активности учащихся на уроке, с использованием мультимедийных презентаций, демонстрационных, исследовательских опытов;
воспитывающие – создать условия для развития способности использования знаний для принятия обоснованного решения.
Тип урока: урок изучения нового материала
Методы обучения:
организация и осуществление учебно-познавательной деятельности:
перцептивные методы – словесные (лекция учителя), наглядные (мультимедийные
презентации), практические (демонстрация опытов);
логические методы – аналитические;
гностические методы – исследовательские (исследование физических и химических свойств фенола);
управление учением – работа в группах под руководством учителя; самостоятельная работа обучающихся: с информационными материалами на карточках, с учебником, письменная работа в таблицах;
стимулирование и мотивация учения:
стимулирование интереса к учению — учебная дискуссия, занимательность, создание ситуации для возможности проявления лидерских качеств;
стимулирования долга и ответственности к учению — убеждение в значимости учения, поощрение в учении;
контроль и самоконтроль в обучении:
устный контроль – индивидуальный, фронтальный опрос.
Форма проведения урока: исследовательский урок с мультимедийным сопровождением
Дидактические средства:
учебник под редакцией О.С.Габриеляна «Химия 10 класс»;
компьютер;
проектор;
экран;
раздаточный материал – инструктивные карточки по проведению исследования в группах формул, строения, физических свойств, способов получения, взаимного влияния атомов в молекуле, химических свойств и применения фенола (Приложение 1-7), раздаточные листы с правилами ТБ, таблицы для фиксирования результатов исследования на листах формата А 4, тесты для формулировки вывода по уроку;
реактивы и оборудование для демонстрации опытов учителю: фенол, хлорид железа(III), щелочной металл натрий, раствор гидроксида натрия, вода, пробирки для демонстрации в штативе, спиртовка, спички, держатель для пробирок;
реактивы и оборудование для проведения исследования учащимися: пробирки с фенолом, раствор гидроксида натрия, вода, чистые сухие пробирки, спиртовка, спички, держатель для пробирок;
демонстрационный материал:
образцы красителей на основе фенола: гуашь
Методическая литература:
Габриелян О.С. Химия.10 класс: Настольная книга учителя /О.С.Габриелян. И.Г.Остроумов/. — М.: Дрофа, 2004.-480с.
Горковенко М.Ю. Поурочные разработки по химии к комплектам О.С. Габриеляна и др., Г.Е. Рудзитиса и др., Л.С. Гузея и др.10(11) класс. М.: «ВАКО», 2005. -320с.- (В помощь школьному учителю)
Карцова А.А., Левкин А.Н. Органическая химия: иллюстрированный курс: 10(11) класс: пособие для учащихся. – М.: Просвещение, 2009.
Карцова А.АХимия 10: учебник для учащихся общеобразовательных учреждений (профильный уровень)/ Карцова А.А., Левкин А.Н..-М.: Вентана –Граф, 2010.-432с.:ил. – (Химический лицей)
План урока:
Организационный момент.
На рабочих столах учащихся подготовлены:
Раздаточный материал — инструктивные карточки по проведению в группах исследования формул, строения, физических свойств, способов получения, взаимного влияния атомов в молекуле, химических свойств и применения фенола.
Инструкции по ТБ.
Таблицы для заполнения результатов исследования (лист А4).
Тесты для формулирования вывода по уроку.
Подносы с реактивами и оборудованием для химического эксперимента (на 4-х ученических столах по количеству групп, выполняющих исследование физических и химических свойств фенола)
Актуализация знаний:
создание проблемной ситуации,
мотивирование учащихся на ее разрешение.
Изучение новых знаний:
Исследовательская деятельность учащихся методом кооперации.
Отчеты групп о проделанной работе – результатах исследования.
Уточнение результатов — комментарии учителя.
Демонстрационное сопровождение слайдами презентации.
Фиксирование результатов в таблицы.
Демонстрационный эксперимент – качественные реакции на фенол.
Формулирование вывода с помощью теста
Подведение итогов урока. Вывод.
Домашнее задание.
Ход урока:
Организационный момент. 1-2 мин.
Актуализация знаний:
Вступительное слово учителя.
-Ребята! 1 декабря группа ваших одноклассников защищала честь своего класса на интеллектуальном экологическом турнире старшеклассников «Семь грецких орехов».
Одним из заданий, доставшихся команде 10 классов, было задание найти лишнее в предложенном перечне веществ и объяснить, почему они так решили. Ответ команда дала правильный, а вот объяснение компетентное жюри не совсем удовлетворило.
Поэтому я предлагаю вам всем классом подумать над этим логическим заданием. Внимание на экран: На экране вопрос: Найдите лишнее среди названных вам веществ, объясните, почему вы так решили. Метанол, толуол, этанол, фенол (слайд 1).
Предполагаемый ответ учащихся: Лишнее вещество толуол, так как это ароматический углеводород, гомолог бензола. Другие названные вещества не являются углеводородами, это кислородсодержащие органические вещества.
— Перенесите знания с последних уроков, посвященных изучению предельных одноатомных и многоатомных спиртов и применяя их к трем оставшимся веществам, исключите еще одно вещество. Поясните.
Предполагаемый ответ учащихся: Исключить можно фенол, так как метанол и этанол — предельные одноатомные спирты, а фенол к гомологическому ряду алканолов не относится.
— Совершенно верно, и мы таким образом, через решение логической задачи, подошли к теме нашего урока – тема урока «Фенол» (слайд 2)
Чтобы точнее разобраться, чем же является фенол, я предлагаю вам провести всестороннее его исследование.
Итак, объектом нашего исследования является органическое кислородсодержащее вещество-фенол
Цель исследования: установить принадлежность фенола к классу органических соединений.
Основополагающий вопрос: «Фенолы – это спирты или самостоятельный класс органических веществ?
На данный момент времени мы можем предположить и тот и другой вариант. Поэтому
гипотезы: —
фенол-это спирт;
фенол – это самостоятельный класс кислородсодержащих органических веществ
Изучение новых знаний:
— Ребята, на столах вы видите заранее приготовленный раздаточный материал. Используя инструктивные карточки, класс разделился на семь групп по предметным областям исследования ( слайд 3), исследовательское задание у каждой группы свое, цель вашего исследования вы сформулируете сами, записи можно производить прямо на карточках, результаты своих исследований будете заносить в специально приготовленную таблицу «Характеристика кислородсодержащего органического вещества фенола». Группы, производящие исследование, методом лабораторного эксперимента начинают работать только после ознакомления с техникой безопасности с разрешения учителя. На выполнение исследования дается 7-8 минут времени. Затем каждой группе будет предоставлена возможность отчитаться перед классом о результатах исследования. Все результаты уточним и законспектируем в таблицы, которые сегодня вам заменят рабочие тетради. Итак, начинаем.
3.1 Работа в группах: каждая пара – это группа, в классе 26 человек, следовательно,
13 парт- 13 групп. Заданий 7, каждое задание выполняется двумя группами, за исключением химических свойств фенола по (-ОН) — группе.
Задание 1 группе:
Карточка №1
Предмет исследования: формулы простейшего одноатомного фенола
Цель исследования:_______________________________________________________________________________
_______________________________________________________________________________
Информация для анализа
Молекулярная формула – С6Н6О
Молекулярная формула с функциональной группой – С6Н5ОН
3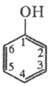 ) Структурная формула
) Структурная формула
4) Для сравнения формулы ароматических спиртов:
С6Н5 – СН2 –ОН; С6Н5 – СН2 – СН2-ОН.
(-ОН)- группа соединена с ароматическим радикалом через боковую цепь.
5) Рассмотрите формулы фенола и распределите предложенные признаки по графам таблицы:
кислородсодержащие органические вещества
содержат функциональную группу (-ОН)
содержат ароматический радикал фенил
общая формула R-ОН
(-ОН) группа соединена с радикалом непосредственно, а не через боковую цепь
| Признаки не характерные для спиртов | |
|
|
|
На основании исследования сделайте вывод, либо о принадлежности фенолов к классу спиртов, либо о самостоятельности класса фенолов как кислородсодержащих органических веществ.
Вывод:_______________________________________________________________________________________________________________________________________________________
Задание 2 группе:
Карточка №2
Предмет исследования: физические свойства фенола
Цель исследования:_______________________________________________________________________________
_______________________________________________________________________________
Инструктивная карточка + инструктаж по ТБ!
На столах в штативах имеются 2 пробирки с фенолом.
Рассмотрите это вещество, очень осторожно! (вещество ядовито!) испытайте его на запах. Опишите его физические свойства.
Затем в одну из пробирок добавьте 2-3 мл воды и аккуратно встряхните. Свои наблюдения запишите в тетрадь.
Вторую пробирку с веществом поместите в горячую воду, отметьте термометром температуру плавления фенола.
| Агрегатное состояние |
|
| Цвет |
|
| Запах |
|
| Растворимость в холодной воде |
|
| Растворимость в горячей воде |
|
| Температура плавления. |
|
Информация для анализа по физическим свойствам фенола
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей.
Это объясняет, почему у фенола довольно высокие температуры плавления (+43) и кипения (+182). Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:
Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена.
Вывод:_______________________________________________________________________________________________________________________________________________________
На основании исследования сделайте вывод, либо о принадлежности фенолов к классу спиртов, либо о самостоятельности класса фенолов как кислородсодержащих органических веществ.
Задание 3 группе:
Карточка №3
Взаимное влияние атомов и групп атомов в молекуле фенола
Цель исследования:____________________________________________________________________
____________________________________________________________________
И нформация для анализа
нформация для анализа
Согласно 3 положению теории А.М.Бутлерова «Атомы и группы атомов в молекулах органических веществ взаимно влияют друг на друга»
В молекуле фенола таких групп две: ароматический радикал фенил (С6Н5 –) и гидроксогруппа (-ОН).
Внимательно рассмотрите рисунок!
Читая текст, снова обращайтесь к рисунку.
Атом кислорода как более электроотрицательный элемент ( «серебряный» призер по э.о.) оттягивает электронную плотность от атома водорода в гидроксогруппе, делая его тем самым подвижным, способным к замещению.
В свою очередь бензольное ядро, обладая запасом электроотрицательности за счет ароматической «шестерки» оттягивает электронную плотность от атома кислорода, а значит от всей гидроксогруппы на себя и так ее там перераспределяет, что в положениях 2-, 4-, 6- на атомах углерода образуются частичные отрицательные заряды и водороды в положениях 2-, 4-и 6- становятся подвижными, а значит могут замещаться.
3) За счет взаимного влияния вероятно возможны реакции замещения водородов в гидроксогруппе ( как у спиртов) и в орто- и пара- положениях ароматического радикала ( подобного у алканолов не наблюдалось)
4) На основании результатов исследования сделайте вывод, либо о принадлежности фенолов к классу спиртов, либо о самостоятельности класса фенолов как кислородсодержащих органических веществ.
Вывод:______________________________________________________________________________________________________________________________________________________
Подготовьтесь к рассказу о взаимном влиянии атомов в молекуле фенола, Возможени вариант использования электронной презентации (слайд7).
Задание группе 4
Карточка №4
Предмет исследования: химические свойства фенола по (-ОН) группе
Цель исследования:_______________________________________________________________________________
_______________________________________________________________________________
Инструктивная карточка + инструктаж по ТБ!
Задание группе: на столах в штативах имеются 4 пробирки; две с этанолом, две других с кристаллическим веществом фенолом.
1 опыт
Одну пробирку с кристаллическим фенолом нагрейте и осторожно расплавьте кристаллы фенола.
В пробирку с расплавленным фенолом и в одну из пробирок с этанолом поместите по кусочку натрия величиной со спичечную головку. Что наблюдаете? Сделайте соответствующий вывод.
2 опыт
Во вторую пробирку с кристаллическим фенолом добавьте 2-3 мл воды, осторожно встряхните.
Добавьте осторожно несколько капель щелочи. Что наблюдаете? Сделайте соответствующий вывод.
| Уравнения реакций фенола нетипичных для спиртов | |
|
|
|
По какой группе идут данные реакции? ______________________________________
Сравните кислотные свойства фенола с кислотными свойствами спиртов_____________________________________________________________________
Вывод_______________________________________________________________________
На основании исследования сделайте вывод, либо о принадлежности фенолов к классу спиртов, либо о самостоятельности класса фенолов как кислородсодержащих органических веществ.
Задание 5 группе
Карточка №5
Предмет исследования: химические свойства фенола по бензольному кольцу
Цель исследования:_______________________________________________________________________________
_______________________________________________________________________________
И зучите уравнение реакции взаимодействия фенола с бромной водой.
зучите уравнение реакции взаимодействия фенола с бромной водой.
Запишите уравнение в таблицу, пронумеруйте атомы углерода в бензольном кольце продукта реакции, назовите его по систематической номенклатуре.
Укажите, что данное вещество является осадком белого цвета, а данная реакция одной из качественных реакций на фенол.
По аналогии запишите уравнение нитрования фенола, назовите продукт реакции.
Существуют ли подобные реакции у спиртов? _______________________________________________________________________________
Вывод:________________________________________________________________________
На основании исследования сделайте вывод, либо о принадлежности фенолов к классу спиртов, либо о самостоятельности класса фенолов как кислородсодержащих органических веществ.
Задание 6 группе
Карточка № 6
Предмет исследования — способы получения фенола
Цель исследования:_______________________________________________________________________________
_______________________________________________________________________________
1.Изучите предложенную информацию о способах получения фенолов
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь).
Промышленный способ получения самого фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4 ( А). Реакция проходит с высоким выходом и привлекательна тем, что позволяет получить сразу два технически ценных продукта – фенол и ацетон.
Другой способ – каталитический гидролиз галогензамещенных бензолов, например, хлорбензола
( Б).
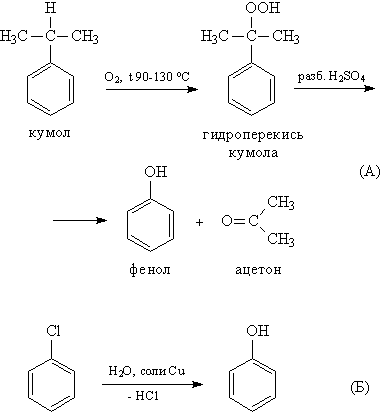
2.Запишите уравнения реакций в таблицу.
3.Возможно ли каким-то из данных способов получить этанол? Докажите уравнением реакции.
Вывод:_______________________________________________________________________________________________________________________________________________________
На основании исследования сделайте вывод, либо о принадлежности фенолов к классу спиртов, либо о самостоятельности класса фенолов как кислородсодержащих органических веществ.
Задание 7 группе
Карточка № 7
Применение фенола на основе свойств
Цель исследования:_______________________________________________________________________________
_______________________________________________________________________________
1.Изучите материал параграфа 10 учебника стр77(последний абзац)-78., рассмотрите рис. 45 на стр.79 учебника Химия 10 класс О.С.Габриеляна
2. Запишите какие вещества можно получить на основе фенола как химического сырья
3. На основании какой реакции образуется фенолформальдегидная смола, из которой получают современные виды пластмасс? Запишите уравнение этой реакции в сокращенном виде, подпишите названия веществ.(стр.78)
4. Ответьте, почему, несмотря на токсичность фенола, он активно используется в качестве химического сырья?
Биологическая роль соединений фенола
| Отрицательная (токсическое действие) | |
эфирные масла (обладают сильными бактерицидными и противовирусными свойствами, стимулируют иммунную систему, повышают артериальное давление. Например, эвгенол, который содержится в гвоздике и базилике) |
загрязнение вод фенольными отходами |
Сделайте вывод о роли фенола в жизни человека___________________________________
_____________________________________________________________________________
3.2 Отчеты групп о результатах исследований – занесение данных в таблицы.
Ввсе результаты уточняются и сопровождаются демонстрацией слайдов презентации для наглядности и возможности конспектирования материала другими группами. (Отчет
1 группы – слайд 4; 2 группы – слайд 5; 3 группы – слайд 6; 4 группы – слайд 7; 5 группы-слайд 8; 6 группы — слайд 9; 7 группы – слайд 10 + гиперссылка на пластмассы – реакция поликонденсации).
После выступления представителя 5 группы учитель демонстрирует качественную реакцию на фенол-взаимодействие с FeCl3.
Подведение итогов урока. Формулирование вывода с помощью ответов на вопросы теста.
Учитель: Ребята! Наше исследование подошло в к логическому завершению, были заслушаны ваши отчеты, каждая группа представила результаты, сделала выводы по своему блоку работы, необходимо сформулировать общий вывод. Я предлагаю сделать это каждому, ответив на вопросы теста по материалу урока. Внимание на экран:
Сформулируйте вывод по уроку, опираясь на ответы вопросов итогового теста
Фенол – это органическое вещество с молекулярной формулой:
а) С2Н5ОН б) С6Н5ОН в) СН3ОН г) С6Н13ОН
2. Подобно спиртам фенол имеет
а) углеводородный радикал (С2Н5— )б) углеводородный радикал (С6Н5-)
в) функциональную группу (-ОН) г) функциональную группу (-NО3)
3. В отличие от спиртов фенол обладает
а) менее сильными кислотными свойствами б) более сильными кислотными свойствами, которые обусловлены влиянием бензольного ядра и подтверждаются реакцией со щелочью в) ярко выраженными основными свойствами
4.За счет взаимного влияния гидроксогруппы на радикал становятся возможными
а) реакции замещения в бензольном ядре: галогенирование и нитрование, не характерные для алкоголей и гликолей б) реакции окисления сильными окислителями в) реакции поликонденсации
5. Несмотря на токсичность, фенол является
а) энергетически выгодным видом топлива б) продуктом питания живых организмов
в) ценным химическим сырьем
6. Фенолы
а) являются углеводородами б) являются спиртами в) образуют самостоятельный класс кислородсодержащих органических веществ.
Прочитайте вывод связным текстом, не зачитывая букв соответствующих правильным ответам (слайд12)
Образец вывода: (гиперссылка на слайде12)
Фенол – это органическое вещество с молекулярной формулой С6Н5ОН.
Подобно спиртам фенол имеет функциональную группу (-ОН).
В отличие от спиртов фенол обладает более сильными кислотными свойствами, которые обусловлены влиянием бензольного ядра и подтверждаются реакцией со щелочью.
За счет взаимного влияния гидроксогруппы на радикал становятся возможными реакции замещения в бензольном ядре: галогенирование и нитрование, не характерные для алкоголей и гликолей.
Несмотря на токсичность, фенол является ценным химическим сырьем.
Фенолы образуют самостоятельный класс кислородсодержащих органических веществ.
 5. Домашнее задание (слайд 13).
5. Домашнее задание (слайд 13).
§ 10,задачи 5,6 стр. 79, ученика «Химия 10 класс» под редакцией О.С.Габриеляна.
Составить цепочки а) от метана до фенолята калия; б) от бутана до 2,4,6- трибромфенола и решить их
Творческиее задания на выбор учащихся :
— составить кроссворд по теме урока;
— написать эссе на тему « Фенол – и «зло» и «благо»;
— составить презентацию «Многоатомные фенолы». ![]()
![]()
