| в 10 классе по теме: «Физические и химические свойства ацетилена»
|
| Составила учитель химии Ерасова О. В. |
Урок химии в 10 классе.
Тема урока «Физические и химические свойства ацетилена».
Цели урока:
Образовательная– способствовать формированию знаний о физических и химических свойствах алкинов, расширению представлений об непредельных углеводородах и их химических свойствах;
Развивающая– способствовать развитию умений самостоятельно обрабатывать, систематизировать и анализировать теоретические и экспериментальные данные, уметь записывать уравнения реакций;
Воспитательная – развитие коммуникативных умений в ходе коллективной работы, убеждение в необходимости использования новых информационных технологий для привлечения химии к пониманию и описанию процессов происходящих в окружающей среде.
Задачи урока:
1. На основании строения предположить химические свойства алкинов;
2.Доказать способность алкинов к реакциям присоединения, окисления и полимеризации.
Тип урока – изучение нового материала.
Метод урока – исследовательский.
Методы обучения используемые на уроке – словесные (беседа, рассказ), наглядные (видеотерминал), практические (лабораторный опыт), новизны (использование компьютеров), контроля (устный опрос, тестирование), аналитические (анализ событий).
Оборудование:
Доска.
Мультимедийный проектор.
Компьютер.
Презентация к уроку в программе PowerPoint.
Видеоролик «Обесцвечивание бромной воды ацетиленом».
Видеоролик «Обесцвечивание перманганата калия ацетиленом».
Видеоролик«Взаимодействие ацетилена с кислородом».
Видеоролик «Обесцвечивание перманганата калия ацетиленом».
Видеоролик«Взаимодействие ацетилена с оксидом серебра».
Видеоролик«Взаимодействие ацетилена с аммиачным раствором хлорида меди».
Видеоролик«Непрочность ацетиленидов металлов».
Инструкция по проведению лабораторной работе.
Карточки с заданиями (тестами).
Учебник Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 10 класс.
Оформление доски:
27.02.14
Физические и химические свойства ацетилена.
План урока:
Организация начала урока………………………………..2 мин.;
Актуализация знаний……………………………………..7 мин.;
Изучение нового материала……………………………….23 мин.;
Этап проверки понимания и закрепления знаний………5 мин.;
Подведение итогов на рефлексивной основе……………3 мин.
Ход урока.
Организационный момент. Цели урока.
Учитель: Здравствуйте! На сегодняшнем уроке перед нами стоит задача – изучить физические и химические свойства ацетилена.
Актуализация знаний.
Фронтальный опрос.
Вопросы:
Какие непредельные углеводороды вы знаете?
-алкены, алкадиены, алкины.
В чём особенности строения алкинов?
— имеют тройную кратную связь.
Назовите общую формулу ацетиленовых углеводородов.
— CnH2n-2.
Алкины(углеводороды ряда ацетилена)– углеводороды с общей формулойCnH2n-2, в молекулах которых имеется два атома углерода, связанных одной ![]() — связью и двумя
— связью и двумя ![]() — связями(тройной связью).
— связями(тройной связью).
Учитель: Давайте поиграем в хорошо известную вам игру “Крестики-нолики”. Выигрышный путь составляют формулы, которые могут соответствовать алкинам:
| С10Н22 | С7Н16
| |
| С6Н12 | С4Н6 | С5Н10
|
| С5Н7 | С4Н8 | С3Н4
|
Каким окончанием мы показываем тройную связь?
— ин
Как называются эти алкины?
— этин (ацетилен), бутин, пропин.
Изучение нового материала.
Физические свойстваалкинов.
C2H2 – C4H6 – газы, C5H8 – C15H28 — жидкости, C16H30 – … – твердые вещества.
Алкены плохо растворимы в воде, но лучше, чем алканы и алкены.
Их температуры плавления и кипения, также как у алканов и алкенов, закономерно повышаются при увеличении молекулярной массы соединения. Алкины имеют специфический запах.
Учитель:Вам нужно заполнить таблицу «Физические свойства ацетилена».
— Обучающиеся самостоятельно, работая с учебником (с. 51, 52) заполняют таблицу
Физические свойства ацетилена.
| Цвет
| Запах | Растворимость в воде
| Относительная плотность по воздуху | Температура кипения (в
| |
| газ | бесцветный | Почти баз запаха | Малорастворим в воде
| Легче воздуха | — 83,8 |
— Проверка самостоятельной работы.
Химические свойства ацетилена.
Учитель: Цель нашего урока — формировать знания о химических свойствах айцетилена как представителя алкинов, расширить представления о непредельных углеводородах и их свойствах.
Ребята, сегодня проведем урок-исследование по изучению химическихсвойств ацетилена.Также проведем виртуальные эксперименты!
Любое исследование включает такие этапы как постановка задач, выдвижение гипотез, экспериментальное подтверждение гипотезы, анализ результатов и выводы.
Задачи исследования:
1). На основании строения предположить химические свойства (3 положение теории Бутлерова);
2). Доказать с помощью опытов способность алкинов к реакциям присоединения и окисления.
На предыдущих уроках вы изучали строение и номенклатуру алкинов и химические свойства алкенов.
Сейчас мы с вами вспомним строение этена (этилена) и сравним его с строением этина (ацетилена);
Пожалуйста, напишите структурные формулы этих веществ;
H – C =C – HH – C ≡ C – H


Н Нэтин или ацетилен
этен
Какие связи характерны для этена? (двойные, сигма и пи);
Какие типы реакций характерны для алкенов? (присоединения, окисления, полимеризации);
А какие связи характерны для алкинов?( тройные, сигма и две пи);
Как вы думаете, будут ли характерны и для алкинов реакции присоединения, окисления и полимеризации? ( да);
Тогда выдвигаем гипотезу нашего исследования:
Для алкинов, как и для алкенов характерны реакции присоединения, окисления и полимеризации.
Реакции присоединения.
а)Галогенирование:
Демонстрация видеоролика «Обесцвечивание бромной воды ацетиленом».
CH ≡ CH + Br2àCHBr = CНBr
ацетилен 1,2-дибромэтен
CH ≡ CH + 2 Br2àCBr2 – CBr2 –
ацетилен1,1,2,2-тетрабромэтан
б)Гидрирование(в присутствии металлических катализаторов – Pt, Pd, Ni):
CH ≡ CH + H2àCH2 = CH2
Ацетилен этен
CH ≡ CH + 2 H2àCH3 – CH3
ацетилен этан
в)Присоединение галогеноводородов:
CH ≡ CH + HBràCH2 = CBr
ацетилен2-бромэтен
CH ≡ CH + 2 HBràCH3 – CBr2
ацетилен 2,2-дибромэтан
г)Гидратация:
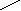
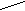 HgSO4 О
HgSO4 О
H
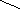 C ≡ CH + H – OH CH3 – C
C ≡ CH + H – OH CH3 – C
ацетилен Н
ацетальдегид
Реакция окисления.
а)Горение.
Демонстрация видеоролика «Взаимодействие ацетилена с кислородом».
2C2H2 + 5 O2à 4 CO2 ↑ + 2 H2O
ацетилен
Смеси ацетилена с воздухом или кислородом взрывоопасны;
ацетилен может также взрываться при ударах.
Демонстрация видеоролика «Взрыв смеси ацетилена и кислорода».
б)Обесцвечивание щелочного раствора KMnO4 – это качественная реакция на непредельные углеводороды (алкины обесцвечиваются быстрее, чем алкены).
Демонстрация видеоролика «Обесцвечивание перманганата калияацетиленом».
3
 CH ≡ CH + 10KMnO4 2Н2О + 2СО2 + 10MnO2 +10KOH
CH ≡ CH + 10KMnO4 2Н2О + 2СО2 + 10MnO2 +10KOH
ацетилен
Реакция полимеризации.
а)Полимеризация в винилацетилен.
C H ≡ CH + CH ≡ CH CH2 = CH – C ≡ CH
H ≡ CH + CH ≡ CH CH2 = CH – C ≡ CH
ацетилен винилацетилен
б)Полимеризация в бензол.
3 C2H2 C6H6
C2H2 C6H6
ацетилен бензол
Реакции замещения (кислотные свойства).
а) Взаимодействие с оксидом серебра
Демонстрация видеоролика «Взаимодействие с оксидом серебра»
HC≡CH + Ag2O → AgC≡CAg↓+ H2O
амм. р-р ацетиленид серебра, белый
б) Взаимодействие с аммиачным раствором хлорида меди
Демонстрация видеоролика «Взаимодействие с аммиачным раствором хлорида меди».
HC≡CH + 2CuCl → CuC≡CCu↓+ 2HCl
ацетиленид меди (I), коричневый
в) Качественная реакция на алкины с концевым положением тройной связи.
Демонстрация видеоролика « Непрочность ацетиленидов металлов».
Закрепление изученного материала.
Задание 1.Закрепление изученного материала. Выполнить тест. Отметить знаком «+» положения, которые считаете верными, и знаком « — « номер неверного положения.
Вопросы:
1.Ацетилен принадлежит к классу алкинов.
2. Общая формула алкиновСn Н 2 n — 2
3. Ацетилен получают из карбоната кальция и воды.
4.Ацетилен мало растворим в воде.
5. Ацетилен — горючий газ.
6. Ацетилен легче воздуха.
7. Для ацетилена типичной реакцией является реакция замещения.
8. Качественной реакцией на ацетилен является изменение окраски бромной воды и перманганата калия.
Задание 2.Выбрать правильный ответ:
1.Состав алкинов выражается общей формулой:
1) CnH2n+2 2) CnH2n 3) CnH2n-2
2.Реакция гидрирования – это реакция присоединения:
1) водорода 2) воды 3) галогенводорода
3. Реакцию гидратации впервые осуществил :
1) Менделеев 2) Кучеров 3)Бутлеров
4.Реакция присоединения галогенов называется:
1) гидрирование 2) гидратация 3) галогенирование
5.Вещество с формулой CH≡C—CH3 называется
1) этен 2) пропин 3) пропан.
Резервное задание. (Разбирается вместе с учениками)
Какие реакции лежали в основе принципа действия карбидных фонарей, применяемых для освещения в 19-ом веке?
Решение: В фонарь, наполненный карбидом кальция, по каплям поступала вода, а получившийся ацетилен поступал в горелку и использовался для освещения.
Подведение итоговурока. Рефлексия.
В заключение – рефлексивный тест.
1. Узнал много нового.
2. М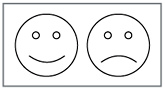 не это пригодится в жизни.
не это пригодится в жизни.
3. Было над чем подумать.
4. На возникшие вопросы я получил ответ.
5. Поработал добросовестно, цель достигнута.
На доске два рисунка с рожицами (с улыбкой и без).
Предлагается выбрать вариант ответа в рефлективном тесте и зарисовать рисунок рожицы, который отражает отношение ученика к проведенному уроку.
Учитель благодарит обучающихся за работу на уроке, комментирует полученные ими оценки.
