Тема урока «Общая характеристика неметаллов», 9 класс
Федотова Е. Г. учитель химии МБОУ СОШ №4 г. Южно-Сахалинск
Цель:
Используя антитезу ( противоположность, противопоставление) с металлами, рассмотреть положение неметаллов а ПС и особенности строения их атомов, вспомнить ряд электроотрицательности.
Повторить понятие аллотропии и кристаллическое строение неметаллов, а, следовательно рассмотреть и их физические свойства.
Показать роль неметаллов. Изучить состава воздуха.
Задачи урока:
Актуализировать знания учащихся о физических свойствах неметаллов, о типах кристаллических решеток;
Характеризовать связи между составом, строением и свойствами неметаллов.
Развивать умения применять знания, сравнивать и делать выводы;
Воспитывать химическую аккуратность по отношению к окружающей среде.
Форма урока: изучение нового материала с элементами лекции.
Методы обучения – объяснительно-иллюстративные, наглядные, практические, словесные, проблемного изложения.
Учебник О.С. Габриелян Химия. 9 класс : учеб. для общеобразоват. Учреждений / О.С. Габриелян. – 11-е изд., испр. – М.: Дрофа, 2006., раздаточный дидактический материал, компьютер, мультимедийный проектор, презентация по теме «Общая характеристика неметаллов».
Ход урока.
I. Организационный момент.
Слайд 1
Запись д.з
II. Актуализация опорных знаний
Слайд 2
На экране ряд элементов, прикрепленных магнитами (хлор, железо, кислород, фосфор, сера ).
— Ребята, уберите лишний элемент, который нарушает некую закономерность.
Правильно. Это железо. А почему вы убрали?
Верно, это металл, а остальные элементы…
Мы с вами знаем, что все химические элементы делятся на металлы и неметаллы. С металлами мы знакомились на прошлых уроках, а сегодня мы познакомимся с неметаллами и дадим им общую характеристику.
Слайд 3
записываем тему в тетради.
Изучать мы начинаем неметаллы и их соединения.
В природе несомненно их велико значение.
Давайте рассмотрим схему, по которой мы будем давать им характеристику: что мы должны узнать сегодня о неметаллах?
Слайд 4
Строение атома →тип химической связи →тип кристаллической решетки →свойства вещества
III. Формирование новых ЗУНОВ
1. Само слово «Неметаллы» противоположно слову «Металлы». Давайте с вами вспомним определение металлов и на его основании дадим определение неметаллам
Слайд 5
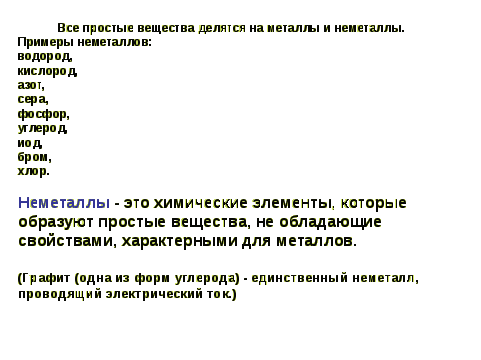
Слайд 6
2. Каково же положение неметаллов в П. С. Хим элементов Д. И. Менделеева?
Слайд 7
3. Давайте с вами вспомним строение атомов металлов и на основании представленных моделей атомов дадим сравнительную характеристику атомам неметаллов. (модели атомов 2 периода на доске)
Учащиеся отвечают на вопросы и заполняют сравнительную таблицу. (таблица1)
4. Почему бор имеет на внешнем энергетическом уровне 3 электрона и при этом относится к неметаллам? (у наго маленький радиус атома)
Слайд 8
5. Как изменяются неметаллические свойства в пределах периода и гл. подгрупп?
Слайд 9
6. Для атомов неметаллов качественной характеристикой неметалличности является Э. О. Дайте опредаление ЭО.
7. Для простых веществ, образуемых неметаллами какой тип химической связи характерен?
А какой для металлов?
(вносим данные в сравнительную таблицу)
Давайте рассмотрим, какой тип химической связи имеют простые вещества неметаллы.
Слайд 10
Рассматриваем схемы образования химической связи в хлоре связи в хлоре (определяем тип ковалентная неполярная)
8. Кристаллическое строение металлов простых веществ.
Какую кристаллическую решетку имею атомы металлов и неметаллов?
Слайд 11
Слайд 12
9. Хотя среди 109 известных хим. к элементам неметаллам относится 22 , неметаллы отличаются большим разнообразием. Среди них есть газы, твердые вещества, жидкости.
Лабораторная работа
Слайд 13
Слайд 14
Изучите коллекцию неметаллов и металлов по фотографиям и коллекциям дайте сравнительную характеристику физических свойств (агрегатное состояние и цвет, металлический блеск) данные занесите в таблицу.
Слайд 15
Неметаллы имеют различное агрегатное состояние при обычных условиях:
газы – H2, O2, O3, N2, F2, Cl2;
жидкость – Br2;
твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Слайд 16
Слайд 17
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода.
Сравнительная характеристика атомов металлов и неметаллов (таблица 1)
| Металлы | Неметаллы | |
| Строение атома | ||
| Число электронов на внешнем уровне | 1-3 | 4-8 |
| Атомные радиусы | Большие по сравнению с неметаллами | Меньшие по сравнению с металлами |
| Свойства | Восстановительные | Окислительные |
| Химическая связь | ||
| Химическая связь в простых веществах | Металлическая | Ковалентная неполярная |
| Кристаллическая решетка. | Металлическая | Атомная, молекулярная |
| Физические свойства | ||
| Агрегатное состояние.
| Твердые Жидкое (ртуть) | Газообразное (О2, Н2) Жидкое (Br 2) Твердое (C) |
| Электро – и теплопроводность. | Электро – и теплопроводны. | Теплопроводность (только графит) Электропроводность (только графит и черный Фосфор.) |
| Металлический блеск | Имеют металлический блеск | Не имеют металлический блеск ( искл. I2, графит -C |
| Цвет | Большинство металлов имеют серебристо-белый цвет | Белый (белый Р) Черный (графит) Красный (Br 2, красный фосфор) Желтый (S) Фиолетовый (I2) Бесцветный(О2, Н2) Зеленый (хлор) (учитель демонстрирует данные неметаллы)
|
Среди всех известных химических элементов только 22 относится к неметаллам, что же служит причиной разнообразия простных веществ неметаллов?
Причиной разнообразия простых веществ неметаллов служит явление, которое называется аллотропией. Дайте определение аллотропии.
Слайд 18
Приведите примеры аллотропных модификаций.
Слайд 19
С чем связано явление аллотропии? (с различным типом кристаллических решеток- алмаз и графит, белый и красный фосфор; с различным числом атомов в молекулах простых веществ- кислород и озон)
Слайд 20
Разным строением кристаллических решеток объясняется и явление аллотропии. Например, элемент фосфор образует простое вещество с молекулярной кристаллической решеткой – белый фосфор, молекулы которого имеют состав Р4, и простое вещество с атомной кристаллической решеткой – красный фосфор Р.
Слайд 21
Вторая причина аллотропии связана с разным числом атомов в молекулах простых веществ. Примером являются кислород О2 и озон О3.
Слайд 22
дать характеристику кислорода и озона учебник стр 90
Слайды 23-25
В отличие от бесцветного кислорода, не имеющего запаха, озон – это светло синий газ с сильным запахом. В природе озон образуется при электрических разрядах или окислении органических смолистых веществ, а также при действии ультрафиолетовых лучей на кислород. В лаборатории его получают в специальных приборах – озонаторах при действии на кислород электрическим разрядом.
Озон – гораздо более сильный окислитель, чем кислород. Поэтому его применяют для: отбеливания тканей, дезодорирования жиров и масел, обеззараживания воздуха и воды.
Озон имеет очень большое значение для сохранения всего живого на нашей планете. Озоновый слой Земли, расположенный на высоте 20-25 км, задерживает губительные ультрафиолетовые лучи, которые разрушительно действуют на клетки живых организмов. Поэтому понятно, как важно сохранить этот весьма чувствительный к действию различных химических веществ «озоновый щит» планеты от разрушения.
Значение озона (видеофильм)
8. Состав Воздуха
Слайды 26-30
просмотр видеофильм о загрезнении воздуха
IV.Развитие новы ЗУНов
Где в ПСХЭ Д.И. Менделеева располагаются неметаллы?
В чем особенность электронного строения неметаллов?
Дать определение Э.О.
Какие агрегатные состояния характерны для неметаллов?
Какай тип связи, характерен для неметаллов — простых веществ?
Какай тип кристаллической решетки, характерен для неметаллов?
Дать определение аллотропии.
Чем она объясняется?
На какие виды делятся компоненты воздуха?
Выводы по схеме Слайды 31
Слайды 32
Тест
Тест по теме «Общая характеристика неметаллов. Кислород, озон, воздух»
1 вариант
1) Знак элемента, образующего простое вещество – неметалл (множественный ответ)
а) Mg б) O в) S г) Cl
2) Среди представленных химических элементов неметаллические свойства наиболее
выражены у:
а) О б) Те в)S г)Se
3) Укажите, какие из представленных веществ имеют аллотропные модификации:
а) хлор
б) бром
в)углерод
г)кремний
4) У атомов-неметаллов число электронов на внешнем энергетическом уровне:
а) 1-4
б) 2-6
в)4-8
г)1-3
5) Для атомов – неметаллов характерны:
а)высокие значения электроотрицательности
б)низкие значения электроотрицательности
6) Алмаз и графит – это аллотропные модификации
а) кислорода
б) углерода
в)серы
г)фосфора
7) Единственный жидкий неметалл – это
а) азот
б) кислород
в)бром
г)йод
8) Для неметаллов характерны следующие типы кристаллических решеток:
а) металлическая
б) атомная
в)ионная
г)молекулярная
9) Воздух – это смесь газов:
а) азот, кислород, благородные газы
б) кислород , водород, инертные газы
в)кислород, азот, водород
г)кислород, азот, хлор
2 вариант
1) Среди представленных химических элементов неметаллические свойства наиболее
выражены у:
а) C б) N в)O г)F
2) Воздух – это смесь газов:
а) азот, кислород, благородные газы
б) кислород , водород, инертные газы
в)кислород, азот, водород
г)кислород, азот, хлор
3) Укажите, какие из представленных веществ имеют аллотропные модификации:
а) хлор
б) кислород
в)бром
г)кремний
4) Знак элемента, образующего простое вещество – неметалл (множественный ответ)
а) Mg б) P в) S г) N
5) У атомов-неметаллов число электронов на внешнем энергетическом уровне:
а) 1-4
б) 2-6
в)4-8
г)1-3
6) Для неметаллов характерны следующие типы кристаллических решеток:
а) металлическая
б) атомная
в)ионная
г)молекулярная
7) Алмаз и графит – это аллотропные модификации
а) кислорода
б) углерода
в)серы
г)фосфора
8) Единственный жидкий неметалл – это
а) азот
б) кислород
в)бром
г)йод
9) Для атомов – неметаллов характерны:
а)высокие значения электроотрицательности
б)низкие значения электроотрицательности
Взаимопроверка тестов выставление оценок
Слайды 33
Рефлексия
Я узнал (а) много нового.
Мне это пригодится в жизни.
На уроке было над чем подумать.
На все возникшие у меня в ходе урока вопросы я получил (а) ответы.
На уроке я поработал (а) добросовестно и цели урока достиг (ла).
