Урок на тему «Соли (c применением здоровье-сберегающих и ИКТ технологий)»
(урок № 3 по теме «Сложные неорганические вещества»)
Химия, 11 класс
Цели урока:
Знать состав, свойства, применение и получение средних, кислых и основных солей, их диссоциацию; уметь экспериментальным путём подтверждать химические свойства средних солей
Развивать умения сравнивать по составу различные виды солей, анализировать их способы получения, процесс диссоциации; формировать навыки экспериментальной работы, способность обобщать и систематизировать полученные знания о солях, их взаимосвязи с другими классами сложных неорганических веществ
Стимулировать деятельность обучающихся, применяя приёмы здоровьесберегающих технологий обучения (хромотерапии)
Оборудование: на столе учителя – набор сухих солей ( NaCl, NaHCO3, K2Cr2O7, K2Cr2O4, NiSO4 , CoSO4, CuS; на столах обучающихся – реактивы: Zn, MgCl2, NaOH, Na2CO3, HNO3, BaCl2, Na2SO4, CuSO4.
Ход урока
Организационный момент.
Опрос.
Учитель: Сегодня на уроке мы продолжим изучать тему «Сложные неорганические вещества». Прежде чем приступить к изучению нового материала, необходимо проверить ваши знания о составе и классификации уже изученных классов веществ.
Опрос будет проходить по группам: I группа (I ряд) – специалисты по оксидам, II группа (II ряд) – специалисты по основаниям, III группа (III ряд) – специалисты по кислотам. Всем обучающимся выдаются цветные листы контроля знаний с немыми (без формул) схемами, отражающими классификации оксидов (I группа), оснований (II группа), кислот (III группа).
I группа будет работать на жёлтых листах. Жёлтый цвет ассоциируется с солнцем и интуицией, стимулирует нервную систему, укрепляет печень и сердце.
II группа получает синие листы. Синий цвет ассоциируется со спокойствием и умом, создаёт атмосферу умиротворения, снимает раздражительность.
III группе достаются красные листы. Красный цвет – цвет жизни, он помогает бороться со стрессом, стимулирует чувственность и возвращает жизненную силу.
Лечение цветом называется хромотерапией. Надеюсь, что данный приём создаст на уроке благоприятную атмосферу и поможет вам справиться с поставленными задачами.
Итак, вспомним состав и классификацию сложных неорганических веществ.
— Какие классы сложных неорганических веществ вы знаете? Ответ: оксиды, основания, кислоты, соли. Посмотрите на доску.

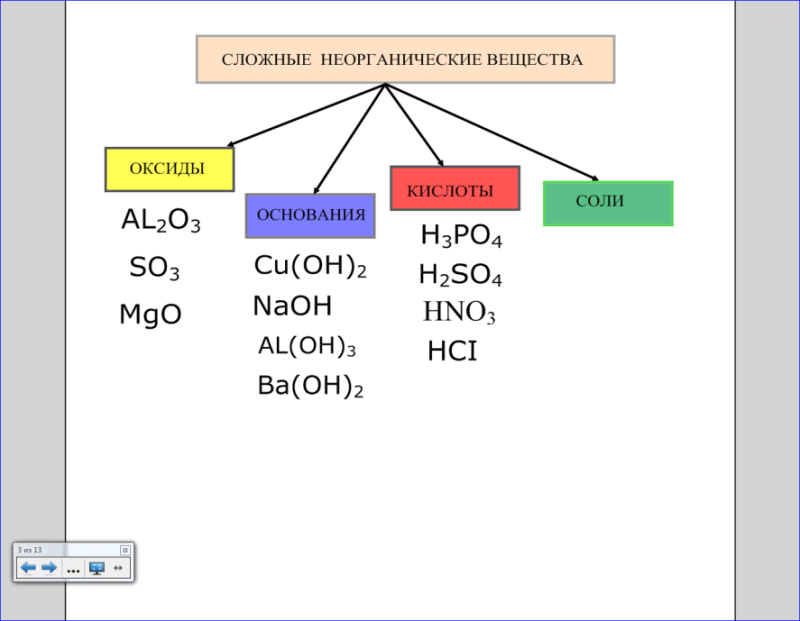
Рис. 1 Рис. 2
— Задание: перемещением распределите по классам формулы указанных веществ. Выходят представители каждой группы и перемещением распределяют по классам формулы оксидов, оснований и кислот (рис. 2).
— Какие вещества называются оксидами? Ответ: оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.
— Назовите выделенные оксиды. Ответ: Al2O3 — оксид алюминия, SO3 — оксид серы (VI), MgO – оксид магния.
— Какие вещества называются основаниями? Ответ: основания — это соединения, состоящие из атомов металла и одного или нескольких гидроксид-ионов OH— , способных замещаться на кислотные остатки с образованием солей.
— Назовите выделенные основания. Ответ: Cu(OH)2 – гидроксид меди (II), NaOH – гидроксид натрия, AL(OH)3 – гидроксид алюминия, Ba(OH)2 – гидроксид бария.
— Какие вещества называются кислотами? Ответ: кислоты — это соединения, состоящие из кислотных остатков и атомов водорода, способных замещаться атомами металлов с образованием солей.
— Как называются выделенные вами кислоты? Ответ: H3PO4 – ортофосфорная кислота, H2SO4 – серная кислота, HNO3 — азотная кислота, HCl – соляная кислота.
— А теперь повторим классификацию оксидов, оснований и кислот.
Идёт работа в группах, учащиеся заполняют немые (без формул) схемы на листах контроля знаний. При этом используются формулы выше названных веществ. По истечении 3-4-х минут проходит проверка на интерактивной доске: используя значок шторки, учитель постепенно открывает заранее заполненные схемы: «Оксиды», «Основания», «Кислоты».
На доске – схема «Оксиды».
— Проверим, как справилась с заданием I группа. Сравните результат своей работы с образцом на доске. Обратите внимание на характер свойств оксидов и соответствующих им гидроксидов.
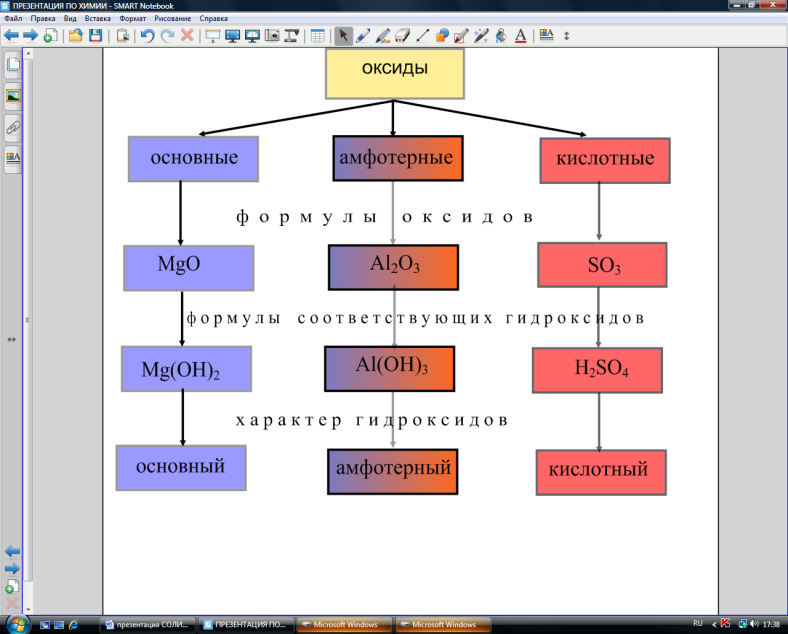
Рис. 3
На доске – схема « Основания ».
— А теперь посмотрим, как распределили формулы оснований по двум классификациям обучающиеся II группы. Сравните результат своей работы с образцом.

Рис. 4
— Сегодня на уроке особенно важно знать деление оснований по кислотности на однокислотные и многокислотные.
В работу включается III группа. На интерактивной доске появляется схема «Кислоты».
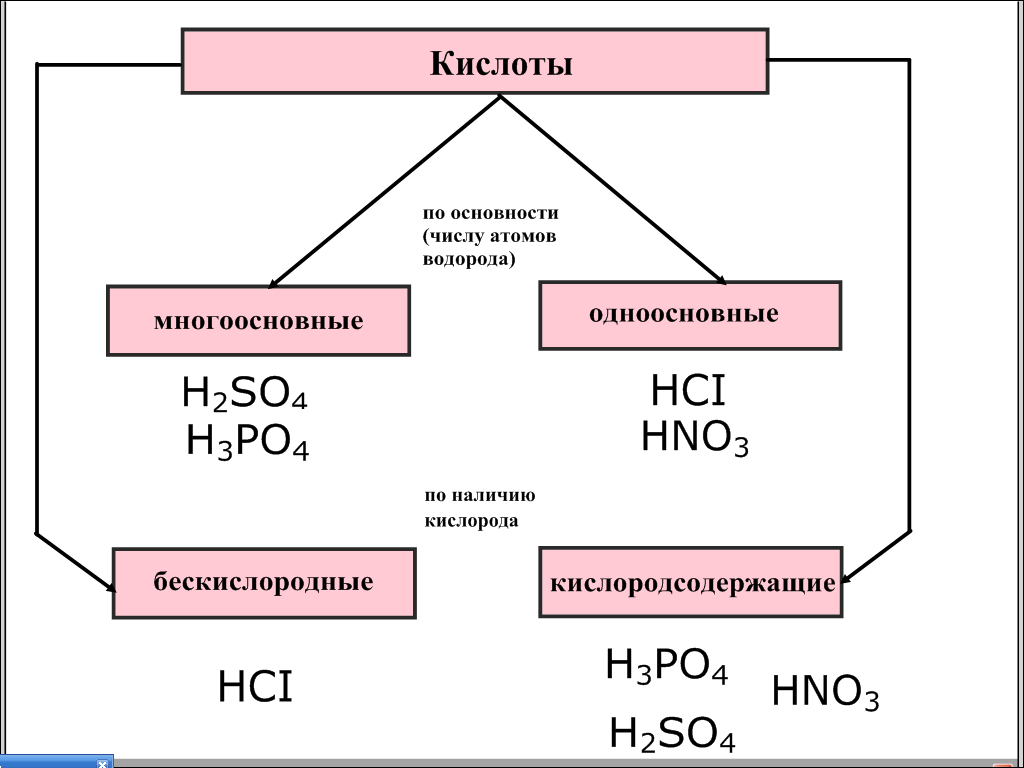
Рис. 5
— Проверьте распределение кислот по двум классификациям. Обратите внимание на то, что кислоты по основности делятся на одноосновные и многоосновные.
— Итак, мы повторили состав и классификацию оксидов, оснований и кислот, а теперь приступим к изучению нового материала.
Изучение нового материала.
— Обратимся к уже знакомой схеме. На доске появляется изображение (рис. 2).
— Какой класс неорганических веществ ещё не изучался? Ответ: соли.
— Они обозначены на схеме зелёным цветом. Зелёный цвет – цвет природы, он успокаивает при болезненных состояниях.
— Сегодня на уроке мы расширим наши знания о солях, их многообразии, свойствах, способах получения и применении.
— Запишите тему урока – «Соли».
— Давайте вспомним, какие вещества относятся к солям. Ответ: соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.
— Сегодня на уроке вы узнаете более полное определение солей.
Соли – это продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла либо продукты полного или частичного замещения гидроксогрупп в молекуле основания кислотными остатками.
Соли очень многообразны по своим свойствам и составу.
На интерактивной доске появляется схема «Соли».
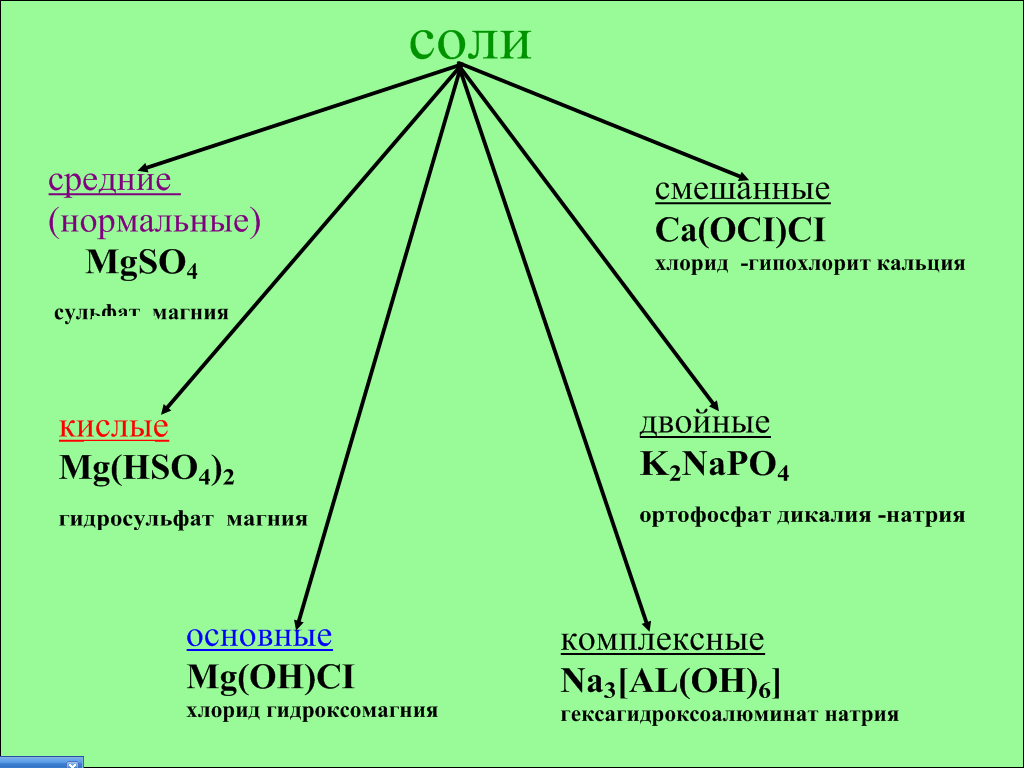
Рис. 6
— Соли очень многообразны по своим свойствам и составу. Как видно из схемы, соли бывают средние (нормальные), кислые, основные, смешанные, двойные, комплексные. В смешанных солях атомы металла связаны с двумя разными кислотными остатками, в двойных – атомы двух металлов связаны с одним кислотным остатком. В комплексных солях выделяют комплексный ион (он пишется в квадратных скобках). Используя значок шторки, учитель закрывает правую часть схемы.
На уроке будут рассматриваться более подробно только средние, кислые и основные соли.
Хочется отметить некоторые физические свойства этих солей. Соли, за небольшим исключением, являются твердыми кристаллическими веществами. Большинство солей белого цвета, такие как гидрокарбонат натрия и хлорид натрия. Некоторые соли имеют оранжевую окраску как дихромат калия, желтую — хромат калия, зеленую – сульфат никеля (II), розовую — сульфат кобальта(II), черную – сульфид меди (II). Учитель демонстрирует названные соли.
Многие соли хорошо растворяются в воде. Кислые соли, как правило, лучше растворимы, чем соответствующие средние, а основные – хуже.
— А теперь поработаем с учебником. Учитель указывает параграф. Обучающиеся открывают нужные страницы.
— Найдите определение средних солей. Ответ: средние соли — это продукты полного замещения атомов водорода в молекуле кислоты на металл или продукты полного замещения гидроксид-ионов в молекуле основания кислотными остатками. Учитель приводит пример средней соли из схемы – сульфат магния.
— Найдите определение кислых солей. Ответ: кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот на металл. Учитель приводит пример кислой соли из схемы – гидросульфат магния.
— Чем по составу кислая соль отличается от средней? Ответ: в кислой соли в кислотном остатке присутствуют катионы водорода.
— При этом в названии соли появляется приставка гидро-.
— Найдите определение основных солей. Ответ: основные соли – это продукты неполного замещения гидроксид-ионов в молекулах многокислотных оснований кислотными остатками. Учитель приводит пример основной соли из схемы – хлорид гидроксомагния.
— В составе основной соли присутствуют гидроксид-ионы, наличие которых в названии указывают приставкой гидроксо- к названию катионов. Обучающиеся выписывают формулы и названия средней, кислой и основной солей из схемы.
Средние, кислые и основные соли при растворении в воде способны диссоциировать на ионы. На интерактивной доске появляется схема.

Рис. 7
— Посмотрите внимательно на схему. Какие особенности диссоциации средних, кислых и основных солей можно отметить? Ответ: средние соли диссоциируют в одну ступень. Кислые и основные соли диссоциируют ступенчато. Учитель просит обучающихся сделать записи в тетради.
— При диссоциации кислых солей образуются два вида катионов – катионы металла и катионы водорода. При диссоциации основных солей образуются два вида анионов – анионы кислотного остатка и гидроксид-ионы.
— А теперь обсудим способы получения каждого вида солей. Соли можно представить как продукты взаимодействия основания и кислоты. На интерактивной доске появляется схема.

Рис. 8
— Какие реагенты используются во всех реакциях? Ответ: реагенты одинаковые – гидроксид кальция и серная кислота.
— Почему же в ходе этих реакций получаются разные соли? Ответ: при получении кислой соли кислота взята в избытке, а при получении основной соли – в недостатке.
— А теперь сделаем записи в тетради: при получении кислой соли основание взаимодействует с избытком многоосновной кислоты. При образовании основной соли кислота взаимодействует с избытком многокислотного основания.
Следует отметить, что при получении средней соли основание может быть разной кислотности, а кислота — разной основности. При этом реагенты берутся в титрованных количествах. Идёт просмотр видео.

Рис. 9 Рис. 10
— Способов получения средних солей много. С некоторыми из них мы встречались при изучении оксидов, кислот и оснований. На интерактивной доске появляется схема, нижняя часть которой закрыта шторкой (рис. 10).
— Некоторые способы получения солей основаны на химических свойствах солей. В этом легко убедиться. Учитель открывает шторку. На схеме отражены химические свойства средних солей.

Рис. 11
— На схеме подчёркнуты те способы получения солей, которые совпадают с химическими свойствами солей. Учитель просит обучающихся открыть учебник, где показаны уравнения реакций, подтверждающие химические свойства солей. При этом указывается на особенности проведения некоторых реакций, в частности, образование нерастворимых продуктов.
— Многие соли имеют двойные названия. В повседневной жизни мы часто пользуемся тривиальными названиями солей. На интерактивной доске следующая страница (рис. 12).

Рис. 12
— Дайте двойные названия предложенных солей. Укажите основные области их применения. Ответ: NaCl – хлорид натрия, поваренная соль (приправа к пище); NaHCO3 — гидрокарбонат натрия, пищевая сода (добавка к тесту); KMnO4 — перманганат калия, марганцовка (медицинский препарат); CaCO3 – мел (строительный материал); (CuOH)2CO3 – карбонат гидроксомеди (II), малахит (ценный поделочный камень); HgCl2 – хлорид ртути (II), сулема (антисептик); NH4Cl — хлорид аммония, нашатырь (медицинский препарат); AgNO3 – нитрат серебра, ляпис (медицинский препарат).
Закрепление. Обучающимся предлагается тест на интерактивной доске. После выполнения работы обучающиеся сдают учителю листы контроля знаний на проверку.

Рис. 13
Домашнее задание: п. 24, упр. № 1 (составить уравнения реакций, иллюстрирующих генетическую связь между важнейшими классами неорганических соединений).
