Урок: Удивительное вещество – вода.
Интегрированный урок химии, 9 класс.
Учитель: Минина Светлана Романовна.
Цель урока: изучить физические и химические свойства воды, значение воды для живых организмов, обобщить и систематизировать знания из естественных наук об основных свойствах воды, раскрыть экологические проблемы, связанные с загрязнением воды.
Задачи урока:
Образовательные: сформировать знания учащихся о составе и свойствах воды; закрепить знания о типах химических реакций, повторить окислительно-восстановительные реакции; способствовать формированию знаний в области ИКТ, в проектно-исследовательской деятельности через различные формы работы и контроля.
Развивающие: развивать наблюдательность, коммуникативность, творческий подход к работе через самостоятельную подготовку к уроку и необычную его форму; развивать информационную культуру учащихся, умения сравнивать прогнозировать, обобщать и делать выводы.
Воспитательные: воспитывать бережное и экономное отношение к водным ресурсам, объяснить необходимость выполнения в повседневной жизни экологических правил, заботиться об окружающей среде и своем здоровье.
Формируемые знания, умения и навыки: систематизация знаний учащихся о распространенности воды в природе, физических и химических свойствах, областях применения воды, расширение знаний учащихся об экологических проблемах, связанных с очисткой воды.
Формируемые компетенции:
учебно-познавательная компетенция: развивать умение сравнивать, анализировать, доказывать, составлять схемы на основе работы с презентацией, быть способным решать следующие жизненно-практические задачи: умение давать оценку состояния окружающей среды, выдвижение своих идей по охране водных ресурсов родного края.
информационная компетенция: развитие умения анализировать и отбирать необходимую информацию, умения готовить презентации и комментировать слайды, умения пользоваться Интернетом для поиска учебной информации.
коммуникативная компетенция: развитие умений вести беседу, диалог, задавать вопросы и отвечать на вопросы учителя и учащихся.
Формы организации работы детей: групповая (просмотр презентации, решение практических задач), индивидуальная (беседа, работа со схемами и кластерами), проблемное обучение (решение проблемных вопросов).
Формы организации работы учителя: организует эмоциональный настрой учащихся, вводит детей в тему урока, обобщает ранее полученные знания, организует беседу по слайдам и опытам, анализирует и дополняет ответы учащихся, создает проблемные ситуации.
Компьютерная презентация к уроку позволяет учащимся:
Получить знания о свойствах и значении воды.
Приобрести навыки работы с веществами и оборудованием.
Получить представление о распространенности воды в природе.
Получить знания о проблемах уменьшения количества пресной воды.
Оборудование: компьютер, мультимедийный проектор, схемы-кластеры, реактивы для демонстрационного эксперимента.
Форма урока: урок-конференция.
Ход урока.
Вступительное слово учителя: « Я очень добродушная, я, мягкая, послушная.
Но, когда я захочу, даже камень источу…»
Отгадайте, о чем идет речь? (на столе – стакан с водой). Слайд № 1.
Химическое вещество – вода всем хорошо известна, и на первых порах кажется, что в этом веществе нет ничего интересного. Но, на самом деле, если всмотреться более внимательно в состав, свойства и значение воды, то можно обнаружить в этом веществе много таких качеств, которые мы не замечали, а, может быть, просто не знали.
Итак, тема нашего сегодняшнего урока – «Удивительное вещество-вода». Мы вспомним все, что знали и не очень из курсов естественных наук. Особое значение уделим изучению физических и химических свойств воды, проведем опыты, обсудим и объясним увиденное и услышанное.
Сегодня мы будем работать не в рабочих тетрадях, а в особых схемах, которые называются кластеры («гроздья»), а также на одном из этапов нашей работы будем заполнять цепочку фазовых переходов воды из одного агрегатного состояния в другое.
Схема кластера: схема№1
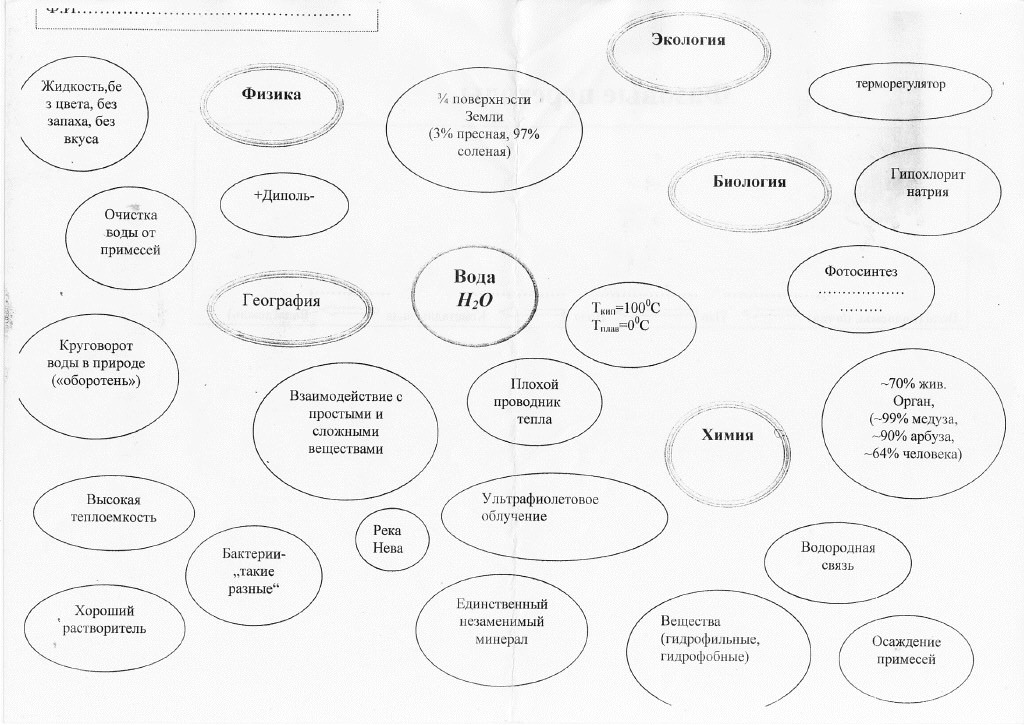
Схема фазовых переходов: схема № 2

Учитель: у нас урок-конференция, поэтому будьте внимательны, слушая выступления своих товарищей. К концу урока вы должны заполнить кластеры, нанизывая «ягоды» на конкретную гроздь из пяти. Наши грозди называются так же, как и наши группы исследователей: география, экология, физика, биология и химия. Внимание: одна «ягода» может держаться за две и более грозди.
Учащийся: читает отрывок из стихотворения С.Щипачева:
«Миллиарды водяных пылинок,
Поднимаются над океаном.
Чтобы тут же в путь пуститься длинный.
По широтам и меридианам.
Стать сгустившимися облаками,
Тучами, чтоб тяжестью воды.
Где-то падать на пески и камни,
На поля, и на сады»
Учитель: Как вы думаете, о каком важном процессе в природе эти слова? (о круговороте)
Выступление 1 группы: «Географы» Слайд № 2
Учитель: во время доклада этой группы учащихся вам необходимо заполнить цепочку фазовых переходов на обороте кластера (схема № 2). Приготовьтесь, будьте внимательны.
Учащиеся: (демонстрируют глобус, карту полушарий.) ¾ поверхности нашей Земли занято водой. Это Мировой океан. 97% это моря и океаны, 3% вода пресная в реках, озерах, подземных водах. Слайд № 3. Воды Земли находятся в непрерывном движении. Круговорот воды связывает воедино все части гидросферы, образуя единую систему: Океан-Атмосфера. Слайд № 4. 85% пресной воды находиться в ледниках. Население Земли не может обойтись без пресной воды. Задумайтесь, за 1 сутки человечество потребляет 7 мрд.куб.м. пресной воды. Слайд № 5. Обратите внимание на Санкт-Петербург на диаграмме.
Естественно, запасы пресной воды на планете исчерпаемы. Что же делать? Плавить ледники? Опреснять соленую воду? Но, для опреснения 1 куб.м. воды требуется 2,3 т. ядерного топлива или 7 млн.тонн обычного топлива. Вода – единственный незаменимый минерал, в отличие от драгоценных металлов, алмазов, топлива, горючего и т.д. Поэтому, единственной разумной альтернативой нам остается забота об экологическом состоянии источников пресной воды.
Учитель: А как это сделать? Давайте пригласим на помощь экологов.
Выступление 2 группы: «Экологи» Слайд № 6
Учащиеся: демонстрация и комментирование слайдов № 7,8, 9 .Рассказ о состоянии воды в Неве и ее притоках. Слайд № 10. Сравнение по графику состояние воды в Неве за несколько лет. Слайд № 11. Вывод: состояние воды в Неве, ее притоках и Ладожском озере из года в год ухудшается.
Учитель: Как же очищается питьевая вода в нашем городе?
Работа с раздаточным материалом: на карточках изложен процесс подготовки питьевой воды. Задание группам: распределите карточки в три колонки, согласно таблице. Слайд № 12.(5 минут). Карточки в первой колонке должны быть расположены в логической последовательности.
Вода большого города.
| Использование мощных насосов | Расходуется много энергии | |
| Удаление крупного мусора, содержащегося в воде | Пропускание воды через специальные решётки |
|
| Обеззараживание воды – уничтожение бактерий | Добавление гипохлорита натрия. Растворяясь, он выделяет хлор | Расходуются химические вещества |
| Дополнительное обеззараживание воды – уничтожение бактерий и вирусов | Ультрафиолетовое облучение |
|
| Отделение взвешенных примесей, чтобы сделать воду более прозрачной | Добавление специальных химических веществ, которые заставляют мелкие частицы соединяться вместе, образовывать хлопья и оседать | Расходуются химические вещества |
| Очистка воды от примесей | Воду пропускают через гравий и песок. Взвешенные в воде частицы прилипают, и вода становится прозрачной |
|
| Отправка воды потребителям | Мощные насосы закачивают воду в водопроводную систему | Расходуется много энергии |
Обсуждение результатов работы. Слайд № 13.
Учитель: Обратите внимание на третью колонку: расходы энергии и химических веществ составляют существенную часть расходов на подготовку чистой воды. Эти расходы, в конечном итоге, составляют стоимость воды для потребителей.
Учитель: Вода является не только важным компонентом природы, но и основной составляющей частью всех живых организмов. Пригласим «Биологов» для объяснения этой темы. И, напоминаю, не забывайте работать с кластерами.
Выступление 3 группы: «Биологи». Слайд № 14.
Учащиеся: Сейчас каждый человек знает, что наш организм на 65% состоит из воды. Слайд № 15,16. .Некоторые ткани – кровь, лимфа на 90% состоят из воды. Даже в костях скелета находится около 20% воды. Вода является главным условием возникновения и развития жизни на Земле. Если астрономы найдут на какой-то планете воду, то можно говорить, что там есть жизнь пусть даже в простых проявлениях. Все химические превращения в живых организмах происходят в водных растворах, поэтому вода входит в состав всех клеточных компонентов.
Такой важный процесс в природе, как фотосинтез, тоже не обходится без участия воды. Слайд № 17, 18.
Учитель: Вода обладает многими удивительными свойствами, резко отличающими ее от всех других веществ. Послушайте сообщение «физиков» об уникальных свойствах воды. Слайд № 19.
Выступление 4 группы: «Физики». Слайд № 20, 21. Многие физические константы воды приняты как эталон, образец. Значит ли это, что свойства воды обычны? Попробуем открыть ее и ее физические свойства для себя заново.
«Вода, у тебя нет ни вкуса, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что необходимо для жизни: ты сама жизнь. Ты исполняешь нас радостью, которую не объяснишь нашими чувствами. С тобой возвращаются к нам силы, с которыми мы простились. По твоей милости в нас вновь начинают бурлить высокие родники нашего сердца.»- эти слова написал французский писатель и летчик Антуан де Сент-Экзюпери после того, как его самолет разбился в пустыне и он несколько дней провел под палящим солнцем.
Рассмотрим физические свойства воды. Слайд № 21-29.
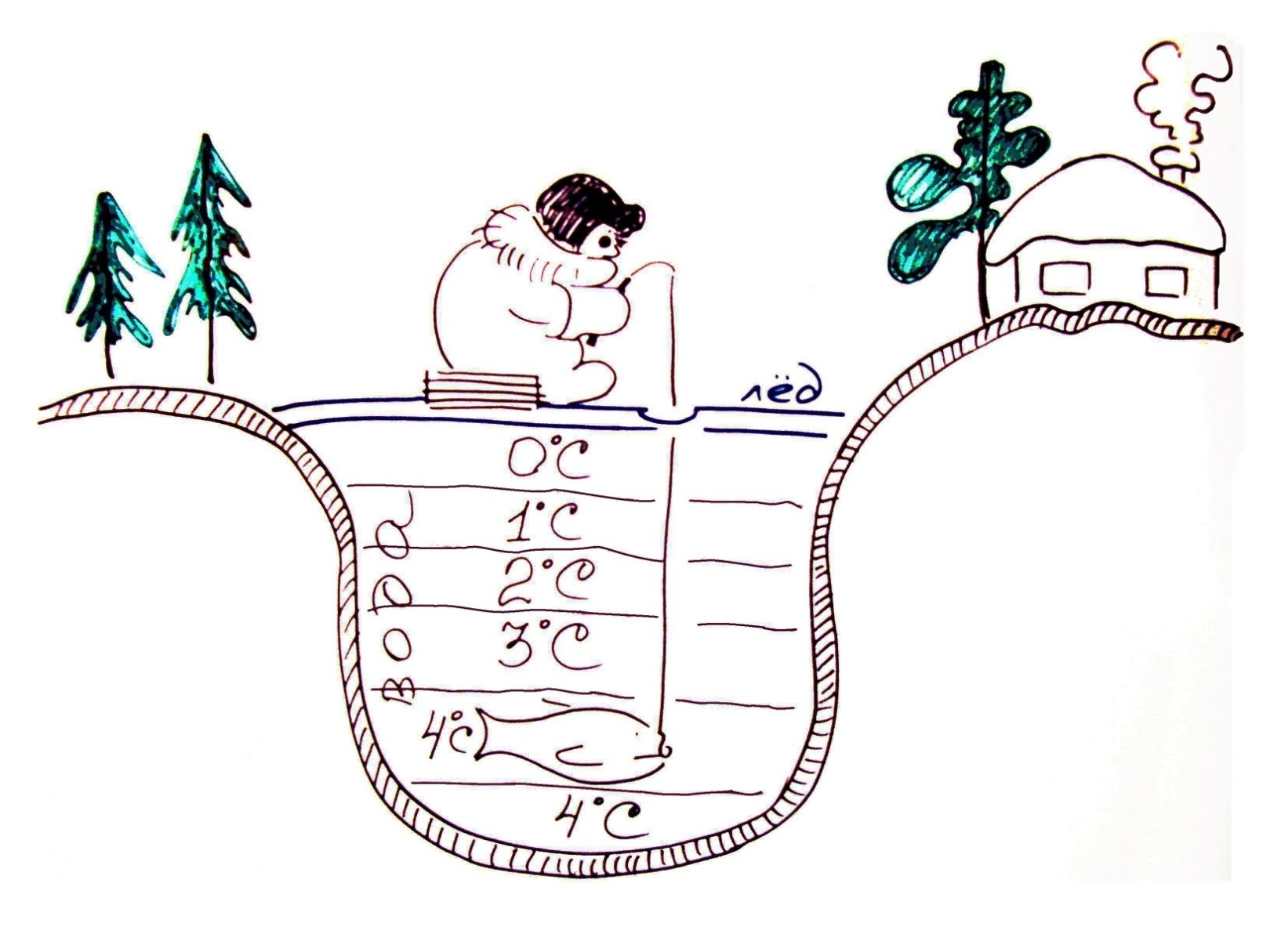
Уникальные свойства воды очень важные для живых организмов, проявляются в своеобразном, почти исключительном поведении воды вблизи точки замерзания. Общеизвестно, что с понижением температуры плотность большинства веществ повышается, а объем уменьшается. Та же закономерность присуща и воде, если ее постепенно охлаждать,…но до +3,98 о С. Дальнейшее охлаждение в интервале температур от +4 до 0 вызывает ее расширение. Таким особым свойством обладают очень немногие вещества. Слайд № 30, 31.
В результате, в водоемах зимой более охлажденная вода, как менее плотная, поднимается вверх, а в придонном слое сохраняется температура +4. Это обеспечивает возможность нормального перенесения холодного сезона для обитателей водоемов Слайд № 32.
Вода – уникальное в природе вещество, важнейшее на планете. Слайд № 33,34.
Учитель: Насколько уникальны и необычны свойства воды, но, ведь, кроме физических свойств, вода еще обладает и химическими свойствами. Это сложное химическое вещество. Оксид. И в заключении рассмотрим это вещество с химической точки зрения. Для этого на нашей конференции присутствуют «химики».
Выступление 5 группы: «Химики». Слайд № 35.
Учащиеся: «Из атомов мир создавала природа,
Два атома легких взяла водорода.
Прибавила атом один кислорода,
И получилась частичка воды,
Море Воды, Океаны и Льды…» Слайд №36.
Строение молекулы воды.
Учащиеся: Вы знаете, что связь между атомами в молекуле воды ковалентная полярная. Куда смещаются электроны? Молекула воды полярна. Она имеет угловое строение Слайд № 37, 38.
Между полярными молекулами воды возможно образование особого вида химической связи – водородной. Слайд № 39,40.
Этим объясняется способность молекул воды объединяться в более крупные комплексы. Это называется ассоциация. А противоположный процесс? – диссоциация. Ассоциацией молекул воды объясняется высокая температура кипения.
Химические свойства. Вода – одно из наиболее реакционно-способных веществ. Из пройденного материала вам известно, что с водой взаимодействуют оксиды.
1. Что образуется при взаимодействии кислотного оксида с водой?
2.Что образуется при взаимодействии основного оксида с водой?
Работа по карточкам: (2 ученика работают у доски)
Закончите уравнения возможных реакций. Назовите типы реакций.
SO2 + H2O = СaO + H2O = CuO + H2O =
N2O5+ H2O = SiO2 + H2O =
Дополнительные вопросы.
1.Какие оксиды не взаимодействуют с водой?
2. Назовите типы реакций.
3. Изменяется ли степень окисления в этих реакциях?
Есть реакции с участием воды, в которых изменяется степень окисления. Вода проявляет окислительные свойства в реакции с активными металлами, например с натрием.
Демонстрационный опыт (проводит учитель). Комментирует свои действия: Кусочек металлического натрия помещаем в стакан с водой. Натрий бурно реагирует с водой с выделением газа – водорода. Добавим фенолфталеин в воду. Раствор окрашивается в малиновый цвет из- за образовавшегося гидроксида натрия. Среда раствора щелочная.
Запишите уравнение, составьте ОВР (ученик работает у доски).
2Na + 2H2O = 2NaOH + H2 .
В некоторых случаях вода проявляет восстановительные свойства
Например, при взаимодействии с фтором. Запишите уравнение:
2 F2 +2H2O = 4HF+ O2 (самостоятельно расставьте степени окисления).
Заключение.
Учитель: Итак, вы познакомились с самым распространенным и уникальным веществом на Земле. Она играет определяющую роль в формировании климата Земли. Вода – растворитель и реагент. Большинство реакций в живой природе происходит в водных растворах и при участии воды. Вода взаимодействует как с простыми, так и со сложными веществами.
Сдаем схему-кластер на проверку.
Рефлексия: Просмотр видеоролика «Гимн чистой воде» Время: 1мин.38 сек.
Домашнее задание: Составление синквейна в рабочих тетрадях. Это слово означает в буквальном переводе «эмоциональное отношение». Синквейн будет состоять из 5 строк.
1. Одним словом (именем существительным) выразите тему сегодняшнего урока
2. Подберите к этому слову 2 прилагательных
3. Подберите к этому слову 3 глагола
4. Составьте фразу, в которой будет отражена значимость этого слова
5. Подберите синоним к этому слову.
Пример «синквейна», написанного учащимися.
1. Вода.
2. Бесцветная, жидкая.
3. Растворяет, орошает, питает.
4. Не все то золото, что блестит.
5. Жизнь.
Литература:
Габриелян О.С. Химия. 8 класс. – М.: Дрофа, 2006
Гузей Л.С. и др. Химия. 8 класс. – М.: Дрофа, 2003
Книга для чтения по неорганической химии./ Сост. В.А. Крицман – ч. 1. М. Просвещение.
Мамедов Н.М., Суравегина И.Т., Глазачев С.Н. Основы общей экологии. М.: МДС, 1998
Чернова Н.М., Галушкин В.М., Константинов В.М. Основы экологии. Учебник для 10–11 классов. М.: Дрофа, 1999;
Петрянов И.В. Самое необыкновенное вещество в мире – М.: Педагогика, 1995.
Бурштейн Л.М. Обыкновенное чудо — вода. – М.: Детский экологический центр, 1997.
https://russian-water.ru/russian-water-main/80-urok-chistoj-vodi.html «Методические материалы к Всероссийскому Уроку Чистой воды».
www.water.ru/bz/likbez/aboutw.shtml «О воде»
https://watermarket.ru/articles/2599 «О запасах пресной воды»
https://www.odnavoda.ru/txt.php?id=145 «Международная академия здоровья о воде»
.
