Муниципальное бюджетное общеобразовательное учреждение
«Гимназия №32»
Конспект урока по химии в 9 классе
тема урока » Щелочные металлы»
Валеева Елена Николаевна,
учитель химии высшей МБОУ «Гимназия №32»
г. Нижнекамск Республика Татарстан
2014
Цель урока: изучить строение, свойства щелочных металлов.
Задачи:
Обучающие.
Рассмотреть строение щелочных металлов, их положение в ПС.
Изучить физические и химические свойства.
Развивающие.
Создать условия для развития умений учащихся анализировать, обобщать, делать выводы, сравнивать.
Воспитывающие.
Способствовать развитию навыков коммуникативного общения учащихся.
Тип урока: комбинированный урок
Формы работы: фронтальная, индивидуальная, групповая.
Тип мышления: Тщательное наблюдение и описание наблюдаемого.
Структура: 800 РУБЛЕЙ САМЭРИ
Мыслительные приемы: ФИНКИН ЭЛАУД
План урока
| действие учителя | действие ученика | примечание | |
| 3 мин. | Организует, мотивирует на работу на уроке, вместе с учениками определяет тему урока. Структура Таймд-Пэа-Шэа
| Приветствуют друг друга, определяют тему урока.
Думают. Делятся развернутыми ответами в течение равного времени с партнером по плечу. |
|
| 30 мин | Изучение нового материала Структура Эй Ар Гайд.
|
Отвечают на утверждения до и после просмотра видеофрагмента о щелочных металлах |
Переосмысление первоначальных знаний |
| Структура Раунд Тэйбл | Думают. Записывают ответы на одном листе бумаги по кругу. |
| |
| Структура 800 Рублей Самэри | Читают параграф. Определяют и записывают главную мысль в рамках заданной темы самостоятельно. | Развитие коммуникативных навыков учащихся | |
| Мыслительный прием Финкин Элауд | Учащиеся проговаривают то, о чем думают после просмотренного видеофрагмента, записывают уравнение химической реакции. |
| |
| 10 мин. | Закрепление. Структура Финк-Райт-Раунд Робин
| Думают. Записывают свой ответ и по очереди обсуждают свои ответы в команде. | Развитие коммуникативных навыков учащихся |
| 2 мин | Рефлексия | Высказывают свое мнение о проделанной работе |
|
ХОД УРОКА.
Организационный момент.
Актуализация знаний учащихся.
Сегодня мы поговорим элементах 1 группы главной подгруппы. Их не зря объединили в одну подгруппу, ведь при взаимодействии с водой они образуют щелочь. Как можно назвать эти металлы?
Структура ТАЙМД-ПЭА-ШЭА
Правильно, тема сегодняшнего урока. Щелочные металлы
Изучение нового материала
Щелочные металлы- самые активные металлы. Но что мы знаем о них? На этот вопрос вы должны ответить самостоятельно, чтобы принять решение — основывайтесь на своих знаниях и убеждениях. В столбике ДО поставьте +, если вы согласны с утверждением или — , если вы не согласны с утверждением
Структура ЭЙ АР ГАЙД
| утверждения | после | |
|
| Щелочные металлы хранятся под слоем керосина |
|
|
| Щелочные металлы активно взаимодействуют с водой |
|
|
| Самый активный металл литий |
|
|
| Щелочные металлы в соединениях проявляют степень окисления +1 |
|
|
| В природе щелочные металлы встречаются в виде соединений |
|
Давайте посмотрим видеофрагмент о щелочных металлах.
После просмотра прочтите все утверждения. В столбике ПОСЛЕ поставьте +, если вы согласны с утверждением или — , если вы не согласны с утверждением. Сравните столбики ДО и ПОСЛЕ. Изменились ли ваши убеждения после просмотра видеофрагмента?
Характеристика щелочных металлов по положению в ПС:
Структура РАУНД ТЭЙБЛ
Щелочные металлы — элементы …… группы, …………… подгруппы.
Радиус атомов ЩМ с возрастанием заряда ядер …………………………
Восстановительные свойства ЩМ с возрастанием заряда ядер ……………………….
Степень окисления щелочных металлов в соединениях равна ……………………….
Предполагаемые ответы учащихся
Щелочные металлы — элементы 1 группы, главной подгруппы.
Радиус атомов ЩМ с возрастанием заряда ядер возрастает.
Восстановительные свойства ЩМ с возрастанием заряда ядер увеличиваются
Степень окисления щелочных металлов в соединениях равна +1
Физические свойства ЩМ
Структура: 800 РУБЛЕЙ САМЭРИ
Учащиеся записывают физические свойства ЩМ, стоимость 1 слова – 80 рублей.
Предполагаемые ответы учащихся Щелочные металлы серебристо-белые, мягкие, легкоплавкие, легкие, режутся ножом, с характерным блеском.
Химические свойства ЩМ
Зная общие физические свойства, активность металлов, предположите химические свойства щелочных металлов. С какими веществами могут взаимодействуют щелочные металлы?
Структура ТАЙМД-ПЭА-ШЭА
Предполагаемые ответы учащихся
Щелочные металлы взаимодействуют как с простыми веществами, и сложными. Активно взаимодействуют почти со всеми неметаллами. Из сложных веществ с водой – образуя растворимые в воде основания – щелочи. Они легко отдают электроны, поэтому являются очень сильными восстановителями. Во всех соединениях проявляют степень окисления +1.
А теперь на опытах убедимся, в правильности наших предположениях о химических свойствах щелочных металлов.
Мыслительный прием ФИНКИН ЭЛАУД
Просмотрите видеофрагмент «Взаимодействие щелочных металлов с водой». Проговорите какие вещества взаимодействуют друг с другом, что получилось в результате реакции. Запишите уравнение реакции.
Информация для любознательных:
Недостаток лития способствует развитию у человека маниакально-депрессивных синдромов психических заболеваний. Приступы способен прекращать карбонат лития. Избыток проявляется в дрожании пальцев, нарушениях равновесия, сонливости, жажде, нарушении сердечного ритма. Литий содержится в свекле.
Натрий поддерживает осмотическое давление крови, активизирует пищеварительные ферменты, суточная потребность составляет 1-2 г. Недостаток натрия приводит к понижению давления. Избыток приводит к перенасыщению тканей и сосудов избытком воды, что приводит к перегрузке всех органов, особенно почек. В результате возникают отеки ног и лица, страдает также сердце. Важнейшим соединением, содержащим натрий является …? (Поваренная соль)
Закрепление
Структура ФИНК-РАЙТ-РАУНД РОБИН
С помощью уравнений реакций осуществите превращения:
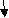 Na → Na2O2 → Na2O → Na2CO3
Na → Na2O2 → Na2O → Na2CO3
NaOH
Запишите уравнения химических реакций.
Домашнее задание.
Параграф 11, задания 1,3*(творческое) стр. 52
Список использованной литературы
Габриелян О.С. Химия. 9 класс. М.: Дрофа, 2010.
Игнатьева С.Ю. Химия. Нетрадиционные уроки, Учитель, Волгоград, 2003
Интернет-ресурсы
https://school-collection.edu.ru
