Муниципальное Автономное Образовательное Учреждение
Ветлужская Основная Общеобразовательная Школа
Конспект урока химии
«Ковалентная химическая связь»
Класс: 8
Подготовил :учитель химии
Беляков Владимир Алексеевич
Р.п Ветлужский , 2013 год
Конспект урока №10
(6 урок из темы « Атомы химических элементов»)
Тема урока: Ковалентная химическая связь.
Тип урока: комбинированный.
Цель урока: расширение знаний о химических связях и их типах; познакомить учащихся с ковалентной связью в различных химических соединениях.
Задачи урока:
Образовательные:
1.познакомить учащихся с типами ковалентных связей (полярная и неполярная);
2.рассмотреть элементарный механизм образования данного вида связи;
3.продолжить учиться составлять электронные формулы атомов химических элементов.
Развивающие:
1.развивать знания учащихся о строении атома;
2.научится определять вид ковалентной связи ;
3.развитие самостоятельности, внимания, логического мышления, умения анализировать.
Воспитательные:
1.создание условий для воспитания активности и самостоятельности.
2.продолжение воспитания химически грамотной личности.
Основные понятия: электроотрицательность, химическая связь. ковалентная связь, полярная и неполярная ковалентная связь, электронная формула, структурная формула.
Место урока в теме: 6 урок из темы « Атомы химических элементов», следующий после изучения Периодический таблицы химических элементов и строения атомов.
Оборудование и реактивы:
1.периодическая система химических элементов Д.И.Менделеева;
2.учебник: Габриелян О. С. Химия. 8 класс; рабочая тетрадь;
3.наборы для составления шаро — стержневых моделей молекул веществ;
4.Проектор и экран;
5.Компьютер;
6.Сопутствуюшее программное обеспечение (MS Power Point);
7.Программа для построения 3D молекул (ACD chemsketch или аналогичное свободно распространяемое);
Планируемые результаты обучения.
Знать определение ковалентной связи, механизм ее образования.
Уметь составлять электронные схемы образования ковалентных соединений, записывать электронные формулы молекул данного вещества, различать соединения с полярной и неполярной ковалентной связью.
План урока:
1.организационный момент (2 мин)
2.проверка ранее изученного материала (8 мин)
3.актуализация знаний (5 мин)
4.изучение нового материала (15 мин) с применением фискульт. паузы (2 мин)
5.закрепление и обобщение изученного материала (10 мин)
6.итоги по уроку (2 мин)
7. задание на дом (1 мин)
8. рефлексия (1 мин)
9.выставление оценок за урок (1 мин)
Ход урока
1.организационный момент (2 мин)
-взаимное приветствие;
-настрой на урок;
-отметить отсутствующих.
-Добрый день, ребята! (приветствие)
-Я рад приветствовать всех Вас на уроке. Сегодня будет не простое занятие потому, что к нам пришли гости. Так что соберитесь и мы начнем урок.
-Дежурный! Доложите кто отсутствует! (доклад дежурного по классу, отметить отсутствующих в журнале.)
2.проверка ранее изученного материала (8 мин)
—фронтальный опрос;
-работа по вариантам.
– Какую тему мы начали изучать на прошлых уроках?
Строение вещества. Химическая связь
– Что мы уже знаем о химической связи?
Химическая связь зависит от строения атома, электроотрицательности, числа внешних электронов.
– как можно изобразить электронное строение атома?
Можно составить электронные и графические схемы- конфигурации строения атомов.
-Что ж проверим как вы этому научились!
(работа по вариантам у доски (задание на листах распечатаны). Вызываются 2 ученика, с учебниками, которые выполняют работу на доске).
1-
2-
1 вариант:
1.По данным о распределении валентных электронов назовите элемент:
а) 2s1
б) 2s22p4
в) 3s23p6
г) 3d104s1
2.Изобразите строение атома азота
2 вариант:
По данным о распределении валентных электронов найдите элемент:
а) 4s24p5
б) 2s22p6
в) 3s23p4
г) 4s24p3
2.Изобразите строение атома кислорода.
Оценивается работа учеников у доски.
Ученики , сидящие за своими местами, выполняют заполнение таблицы в своей тетради.
-Ну, что ж молодцы! Оценки тем, кто работал у доски:
1-
2-
Остальные сдадут мне заполненные таблицы в конце урока на проверку.
3.актуализация знаний (5 мин)
—фронтальная беседа
-Давайте вспомним, что же такое химическая связь вообще?
химическая связь — это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы
— Какова же причина образования химической связи? Почему атомы образуют химические связи?
Причина в стремлении атомов к стабильной электронной конфигурации.
-Атомы каких химических элементов практически не образуют химических связей?
Инертные газы, так как они имеют стабильную электронную конфигурацию.
— Сегодня мы продолжаем изучение строение веществ. На сегодняшнем уроке мы с вами должны расширить знаний о химических связях и их типах; познакомиться с ковалентной связью в различных химических соединениях.
Тема сегодняшнего нашего урока является «Ковалентная химическая связь», запишите эту тему себе в тетрадь. (запись темы на доске)
4.изучение нового материала (15 мин)
-изложение материала.
-В слове «ковалентная» приставка «ко-» означает «совместное участие». А «валента» в переводе на русский – сила, способность. В данном случае имеется в виду способность атомов связываться с другими атомами.
При образовании ковалентной связи атомы объединяют свои электроны как бы в общую «копилку» – молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
Рассмотрим возникновение ковалентной связи на примере образования молекулы водорода из двух атомов водорода. Этот процесс уже является типичной химической реакцией, потому что из одного вещества (атомарного водорода) образуется другое – молекулярный водород. Внешним признаком энергетической выгодности этого процесса является выделение большого количества теплоты.

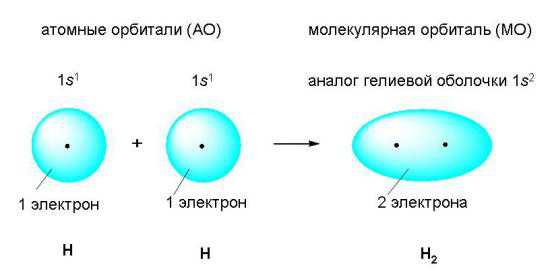
(зарисовать в тетрадь!)
Возникновение ковалентной связи при образовании молекулы водорода из двух атомов водорода. Электронные оболочки атомов водорода (с одним s-электроном у каждого атома) сливаются в общее электронное облако (молекулярную орбиталь), где оба электрона «обслуживают» ядра независимо от того, «свое» это ядро или «чужое».
Американский химик Дж. Льюис в 1916 году предложил обозначать электроны точками рядом с символами элементов. Одна точка обозначает один электрон. В этом случае образование молекулы водорода из атомов записывается так:
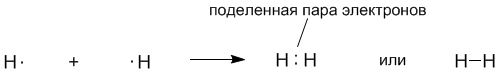
(зарисовать в тетрадь)
Оказалось, что формулы Льюиса имеют глубокий химический смысл. Связь между атомами водорода обозначается парой электронов. Как предположил Льюис, именно пара электронов позволяет образовать ковалентную связь. Впоследствии это предположение подтвердилось квантовой теорией.
Ковалентной связью называется связывание атомов с помощью общих (поделенных между ними) электронных пар. (запись в тетрадь)
Рассмотрим связывание двух атомов хлора 17Cl (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора. Для этого запишем формулу Льюиса для атома хлора и конфигурацию его внешней электронной оболочки:

На внешнем электронном уровне хлора содержится s2 + p5 = 7 электронов. Поскольку электроны нижних уровней не принимают участия в химическом взаимодействии, точками мы обозначили только электроны внешнего, третьего уровня. Эти внешние электроны (7 штук) можно расположить в виде трех электронных пар и одного неспаренного электрона.
После объединения атомов в молекулу из двух неспаренных электронов атомов получается новая электронная пара:
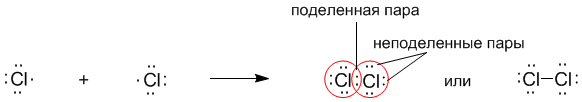
(зарисовать в тетрадь)
Давайте немного отдохнем и проведем физкульт.минутку
1. Быстро поморгать, закрыть глаза и посидеть спокойно, медленно считая до 5. Повторить 4-5 раз.
2. Крепко зажмурить глаза (считать до 3), открыть глаза и посмотреть вдаль (считать до 5). Повторить 4-5 раз.
3. Вытянуть правую руку вперед. Следить глазами, не поворачивая головы, за медленными движениями указательного пальца вытянутой руки влево и вправо, вверх и вниз. Повторить 4-5 раз.
4. ногу согнуть в коленке и носком ноги «начертить» знак химических элементов : кислорода, водорода и сера.(один заход с ноги)
5.
| Упражнения | |
| Реакции обмена | Правое плечо вверх – вниз 5 раз; |
| Вы словно перемена. | Левое плечо вверх – вниз 5 раз. |
| Их признаки запомним навсегда! | Руки к плечам согнутые в локтевом суставе и повороты в плечевом суставе вперед – назад 5 раз; |
| Нам газа запах сладок, | Руки вверх – 5 раза; |
| И выпавший осадок, | Руки вниз – 5 раза; |
| И абсолютно новая вода! | Руки согнуты в локтях впереди, вращение в локтевом суставе вперед и назад 5 раз. |
-теперь мы с вами перейдем к типам ковалентной связи.
Задание: Теперь откройте учебник а странице и выпишите чем отличается ковалентная полярная связь от не полярной.
(проверка выполнения)
Отвечает:
Подсказка: не полярная связь у 2 одинаковых атомов одного элемента в 1 молекуле (ЭО у них одинакова), полярная у разных атомов с разной электроотрицательностью.
Задание: В качестве примера полярной связи, рассмотрим образование воды в реакции между атомами водорода (Z = 1) и кислорода (Z = 8). Для этого удобно сначала записать электронные формулы для внешних оболочек водорода (1s1) и кислорода (…2s2 2p4).
К доске идет и пишет ЭФ :
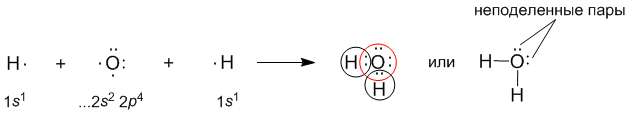
(запись в тетради)
Связь в молекуле воды – полярная ковалентная, а на атомах появляются частичные положительные и отрицательные заряды. Это связано с ЭО элемента. ( обратить внимание на таблицу ЭО!)
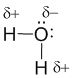
Вспомните, что такое Электроотрицательность?
Электроотрицательность (ЭО) — это способность атомов химического элемента притягивать к себе общие электронные пары в соединении. Электроотрицательность – своеобразная мера неметалличности химических элементов.
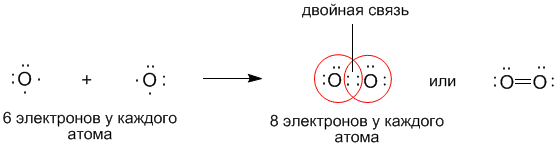
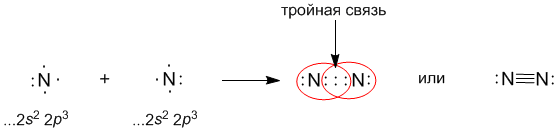
Задание : у доски записать образование ковалентных связей у:
N2 —
О2 —
••
•• N •• N •• — электронная формула молекулы азота,
••
N ≡ N — структурная формула молекулы азота.
5.закрепление и обобщение изученного материала (10 мин)
-Многие люди считают химию скучным и сложным предметом. И при этом утверждают, что многое нельзя потрогать, рассмотреть .Вот вы как думаете, можно ли ощутить или увидеть Химическую связь ?
(затруднение в ответе)
-Да, конечно, мы атомы не сможем потрогать. Но что нам сможет заменить их, что мы сможем ощутить, увидеть не вооруженным глазом?
Модель.
-Вспомните из уроков информатики что такое модель?
Модель – это некий новый объект, который отражает существенные особенности изучаемого объекта, явления или процесса.
-Правильно. Сейчас мы смоделируем поочерёдно атомы водорода, хлороводорода.
(с помощью наборов для составления шаро-стержневых моделей молекул веществ ученики составляют молекулы)
-Молодцы !А сейчас мы с Вами еще вспомним одну программу, благодаря которой можно так же построить модели молекул. Мы уже ее знаем и работали с ней.
(Построение моделей водорода, кислорода, хлора, фтороводорода в ACD chemsketch) :
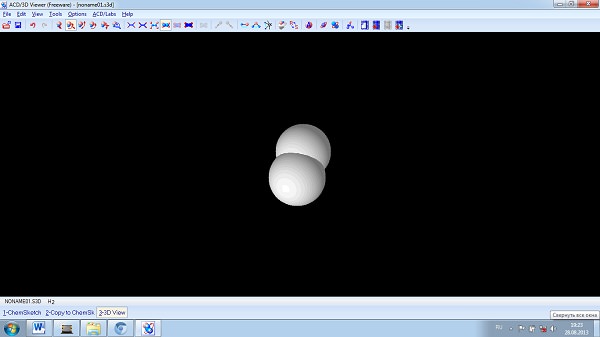 водород
водород
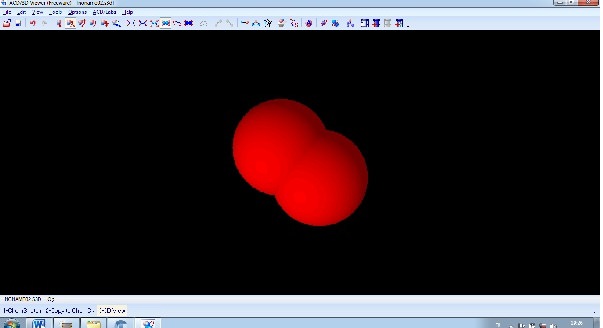
Кислород
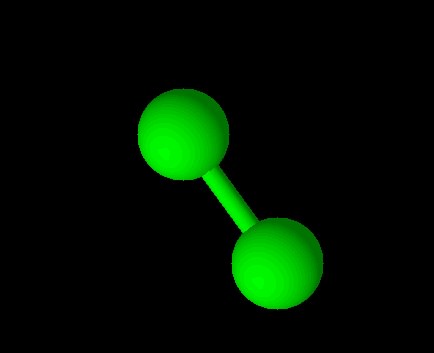 Хлор
Хлор
Ф тороводород
тороводород
6.Итоги уроку (2 мин)
1. С каким новым видом связи мы познакомились на этом уроке?
Отв-
2. Между какими частицами образуется ковалентная химическая связь?
Отв-
3. Какие типы ковалентной химической связи вам известны?
Отв-
4. Как образуется ковалентная не полярная связь? А как ковалентная полярная?
Отв-
Отв-
7. задание на дом(1 мин)
Всем: записи в тетради (выучить)
Параграф № (стр. — )
1 вариант: упражнение № стр.
2 вариант: упражнение № стр.
8. рефлексия (1 мин)
На маленьких листочках (заранее выданных) поставите галочку рядом с рисунком , отображающим ваше настроение. Листочки сдать в конце урока
9.выставление оценок за урок (1 мин)
1-
2-
3-
4-
5-
6-
7-
8-
Всем спасибо, урок закончен!
Самоанализ урока химии по теме: «Ковалентная связь» в 8 классе
Анализируемый урок, ведется по программе О.С Габриеляна (2 ч. в неделю). В 8 классе обучаются учащиеся, мотивированные на учебу. Предмет химии изучается первый год.
Место урока: 6 урок из темы « Атомы химических элементов», следующий после изучения Периодический таблицы химических элементов и строения атомов.
Урок тесно связан с предыдущими занятиями данной темы и опирается на знания учащихся о строении атомов химических элементов, понятие электроотрицательность и др. На предыдущем уроке учащиеся познакомились с основными видами связей в соединениях.
Основной целью данного урока являлось расширение знаний о химических связях и их типах и знакомство учащихся с ковалентной связью в различных химических соединениях.
Задачи урока:
Образовательные:
1.ознакомить учащихся с типами ковалентных связей (полярная и неполярная);
2.рассмотреть элементарный механизм образования данного вида связи;
3.продолжить учиться составлять электронные формулы молекул бинарных соединений.
Развивающие:
1.развитие знания учащихся о строении атома;
2.научится определять вид ковалентной связи ;
3.развитие самостоятельности, внимания, логического мышления, умения анализировать.
Воспитательные:
1.создание условий для воспитания активности и самостоятельности.
2.продолжение воспитания химически грамотной личности.
Для реализации поставленных задач был выбран урок комбинированного типа (тип урока). Данный урок был построен на сочетании фронтальной и индивидуальной работы.
Урок начинается с организационного момента, задача которого — подготовить учащихся к работе на уроке. (Приветствие друг друга, запись в журнал фамилии тех, кто отсутствует, проверка готовности ребят к занятию.) Этот этап урока, хотя и был непродолжительным, позволил быстро включить учащихся в ход урока.
Следующий этап — обзор изученного материала — повторение ранее изученных тем и проверка домашнего задания. Задача — выявить пробелы в знаниях и устранить их, совершенствовать знания и умения, подготовиться к восприятию новой темы. Работа происходила следующими образом: 2 человека отвечали у доски по карточкам- вариантам, остальные работали с нетбуками, программой и таблицей. Их задача — заполнить пробелы в таблице. В конце урока таблицы сдавались на проверку.
Затем была проведена актуализация опорных знаний в которой кратко подняты вопросы прошлых уроков. Так же была сообщены тема, цели и задачи урока ( задачи обозначены на слайде)
Этап изучения нового материала начался с вводной беседы по данной теме . Поскольку ребята уже знают некоторые важнейшие теоретические вопросы курса химии, то большую часть учебного материала этого урока преподнесены дедуктивно. Для этого учащимся предлагаются вопросы, при ответе на которые школьники привлекают ранее приобретенные знания и в то же время изучают новый материал. К тому же это позволяет использовать такие важнейшие принципы дидактики, как научность и доступность. Новые понятия и схемы реакций предлагались учащимся по слайдам презентации и записывались на доске. Соблюдая принцип систематичности материал излагался по пути от известного к неизвестному, от простого к сложному.
Так же, во время изучения нового материала была проведена физкультурная пауза для снятия напряжения.
Цель этапа закрепления была заключена в визуализации сложных понятий – молекула и химическая связь, которых нельзя визуально осмотреть или увидеть невооруженным взглядом. Было предложено 2 варианта : работа с шаро — стержневыми моделями молекул веществ и программой ACD chemsketch (свободно распространяемая). С шаро — стержневыми моделями молекул веществ работал каждый учащийся. Были построены и рассмотрены молекулы водорода и хлороводорода. С программой работали в группах по 2-3 человека.
После этого были выведены краткие итоги по уроку и проведено Домашнее задание. Инструктажу по выполнению домашнего задания было уделено особое внимание, т.к. оно было дано по вариантам всему классу.
Завершающим этапом была оценка учителем результатов урока, подведение итогов, комментирование деятельности учащихся, выставление отметок.
В ходе урока были использованы объяснительно-иллюстративные методы (беседа, объяснение учителя), применялись средства наглядности (слайды презентации) и др.
Личностно-развивающая линия реализована через эмоциональный настрой на работу, различные виды деятельности (выполнение тестов, самостоятельная работа, а также разнообразные формы работы (фронтальная, индивидуальная). Все предложенные учащимся задания способствовали развитию их психо — эмоциональной сферы — внимания, мышления, способности к аналитической и оценочной деятельности. Дифференцированное домашнее задание направлено на развитие познавательной мотивации учащихся.
В итоге цель и задачи урока были достигнуты , так же как и планированные результаты обучения.
Приложение 1
1 вариант:
1.По данным о распределении валентных электронов назовите элемент:
а) 2s1
б) 2s22p4
в) 3s23p6
г) 3d104s1
2.Изобразите строение атома азота
2 вариант:
По данным о распределении валентных электронов найдите элемент:
а) 4s24p5
б) 2s22p6
в) 3s23p4
г) 4s24p3
2.Изобразите строение атома кислорода.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Использованные материалы и Интернет-ресурсы
1)https://www.google.ru/search?q=%D0%BA%D0%BE%D0%B2%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%B0%D1%8F+%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F+%D1%81%D0%B2%D1%8F%D0%B7%D1%8C&newwindow=1&espv=2&biw=1366&bih=624&source=lnms&tbm=isch&sa=X&ei=UPgFVISMFYjhywPAjYLQDg&ved=0CAYQ_AUoAQ
2)https://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%B2%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%B0%D1%8F_%D1%81%D0%B2%D1%8F%D0%B7%D1%8C
3) http://www.alhimikov.net/himsvyas/Page-1.html
4) http://www.alhimik.ru/teleclass/konspect/konsp3-01.shtml
5) http://www.hemi.nsu.ru/ucheb132.htm
6) http://www.alhimik.ru/stroenie/gl_14.html
7) http://www.hemi.nsu.ru/ucheb174.htm
8) http://www.acdlabs.com/resources/freeware/chemsketch/
Список использованной литературы
1. Фельдман, Рудзитис. Химия 7-11 класс. 1985 г. ч1 и ч2
2. Некрасов. Основы общей химии. 1973 г. т1 и т2
3. Глинка. Общая химия. 2001 г
