МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 63 г. БРЯНСКА»
РАЗДАТОЧНЫЙ МАТЕРИАЛ ПО ТЕМЕ
«ХИМИЧЕСКАЯ СВЯЗЬ»
химия
8 класс
Автор:
Учитель химии
МБОУ СОШ № 63 г. Брянска
Гайдукова Александра Павловна
| Таблица 1. Типы химической связи веществ
Задание 6 .(Выполните это задание, если вы находитесь на I варианте). Определите тип химической связи в соединениях, формулы которых приведены: SO3_________________________________________ ClF3________________________________________ Br2_________________________________________ (H2O)3_______________________________________ CaCl2_______________________________________ Cu__________________________________________
Задание 7. (Выполните это задание, если вы находитесь на II варианте). Определите тип химической связи в соединениях, формулы которых приведены: N2_________________________________________ CO2________________________________________ KI__________________________________________ (NH3)2_______________________________________ HBr_________________________________________ Mg__________________________________________
Оценка учителя |
| Число неспаренных электронов | |
| N |
|
| O |
|
| Se |
|
| Br |
|
| P |
|
| F |
|
| S |
|
| Cl |
|
Продолжайте изучать!
Механизм образования ковалентной неполярной связи
Рассмотрим механизм образования ковалентной неполярной связи на примере молекулы водорода H2. (Объясните, почему в молекуле водорода присутствует ковалентная неполярная связь?). В состав молекулы Н2 входит два атома водорода: Н и Н. Изобразите электронно-графические формулы строения каждого атома:
Н Н
Как видно из построенных вами электронно-графических формул, число неспаренных электронов в каждом атоме водорода равно________. Соедините неспаренные электроны каждого атома волнистой чертой . У вас получилось схематическое изображение образования ковалентной неполярной связи в молекуле водорода.
Подведём итог! У каждого атома водорода______ неспаренный электрон, расположенный на_____ энергетическом уровне. На этом энергетическом уровне могут находиться только два электрона. Следовательно, атому водорода для завершения энергетического уровня необходим ещё ______ электрон. Между атомами водорода в процессе возникновения химической связи образуется общая электронная пара, которая в равной степени принадлежит каждому атому водорода. В результате у каждого атома – ______ электрона. Поскольку оба атома водорода обладают одинаковым значением ЭО, то общая электронная пара не смещается в сторону какого-либо атома. Поэтому данный тип связи и называется ковалентной неполярной связью. Электронная схема образования ковалентной неполярной связи в молекуле водорода выглядит так:
Н. + .Н Н : Н. Если заменить общую электронную пару чертой, вы получите структурную формулу молекулы: Н – Н. Если общих электронных пар несколько, каждая пара заменяется чертой.
Выполните!
 Задание 4. Изобразите механизм образования ковалентной неполярной связи в молекулах Cl2, O2 с помощью электронно-графических, электронных и структурных формул. Рядом со схемами укажите: а) число неспаренных электронов каждого атома; б) число электронов на внешнем уровне каждого атома; в) число общих электронных пар в каждой молекуле.
Задание 4. Изобразите механизм образования ковалентной неполярной связи в молекулах Cl2, O2 с помощью электронно-графических, электронных и структурных формул. Рядом со схемами укажите: а) число неспаренных электронов каждого атома; б) число электронов на внешнем уровне каждого атома; в) число общих электронных пар в каждой молекуле.
Выполните задание на чистой стр.4
Продолжайте изучать!
Механизм образования ковалентной полярной связи
Рассмотрим механизм образования ковалентной неполярной связи на примере молекулы хлороводорода HCl (Объясните, почему в молекуле хлороводорода присутствует ковалентная полярная связь?). В состав молекулы HCl входит два атома: _____ и ______. Изобразите электронно-графические формулы строения каждого атома:
Н
Сl
Как видно из построенных вами формул, атом водорода имеет_____неспаренный электрон, атом хлора — _____неспаренный электрон. Соедините неспаренные электроны каждого атома волнистой чертой . У вас получилось схематическое изображение образования ковалентной поляной связи в молекуле хлороводорода.
Подведём итог! У атома водорода______ неспаренный электрон, расположенный на_____ энергетическом уровне, у атома хлора______неспаренный электрон, расположенный на______энергетическом уровне. Следовательно, атому водорода и атому хлора для завершения энергетического уровня необходим ещё ______ электрон. Между атомами водорода в процессе возникновения химической связи образуется общая электронная пара, которая принадлежит и атому водорода, и атому хлора. В результате у каждого атома – завершённая электронная оболочка. Общая электронная пара в случае ковалентной полярной связи смещается в сторону более электроотрицательного элемента. Поскольку из двух атомов,H и Cl, наибольшей ЭО обладает атом_______, то общая электронная пара смещается в сторону атома_______. Электронная схема образования ковалентной неполярной связи в молекуле водорода выглядит так:
Н. + .Cl Н :Cl (на электронной схеме общую электронную пару изображают ближе к более ЭО атому). Если заменить общую электронную пару чертой, вы получите структурную формулу молекулы: Н – Cl. В структурной формуле смещение общей электронной пары показывают с помощью стрелки: H Cl. В результате смещения электронной пары каждый атом в молекуле приобретает частичный заряд: водород – частичный положительный заряд (ему легче «дышать» после смещения электронной пары), хлор – частичный отрицательный заряд (он перетягивает на себя «лишний груз»), т.е. образуются два «полюса». Поэтому данный тип связи и называется ковалентной полярной связью.
P.S. Если число неспаренных электронов атома1 больше, чем число неспаренных электронов атома2, необходимо взять такое количество атомов2, чтобы число неспаренных электронов совпадало.
Выполните!
Задание 5. Изобразите механизм образования ковалентной полярной связи в молекулах HBr, H2S с помощью электронно-графических, электронных и структурных формул. Рядом со схемами укажите: а) число неспаренных электронов каждого атома; б) число электронов на внешнем уровне каждого атома; в) в сторону какого атома смещаются общие электронные пары. Ответ поясните.
При нехватке места используйте оборотную сторону листа.
Задание 4
Задание 5
О ценка учителя
ценка учителя
| Число отданных/принятых электронов | Ион | Тип иона | |
| K | –1e |
|
|
|
|
| Br— |
|
|
|
| Al+3 |
|
| C | + 4e |
|
|
|
|
| P+5 |
|
| P | +3e |
|
|
|
|
| Cl+3 |
|
| Ba |
|
|
|
| Mn |
| Mn+7 |
|
| Si |
|
| анион |
| H |
|
|
|
Изучите!
Механизм образования ионной связи
Рассмотрим механизм образования ионной связи на примере хлорид лития LiCl. Данное соединение образовано ионами лития и ионами хлора. Покажем образование этих ионов с помощью электронно-графических формул:







 — 1е
— 1е


 Li Li+
Li Li+
1s22s1 1s2 (электронная конфигурация атома благородного газа гелия)















 +1e
+1e

 Cl Cl—
Cl Cl—
1s22s22p63s23p5 1s22s22p63s23p6 (электронная конфигурация благородного газа аргона)
На полученной схеме покажем переход электрона с внешнего уровня атома лития на внешний уровень атома хлора.







 — 1е
— 1е


 Li Li+
Li Li+
1s22s1 1s2















 +1e
+1e

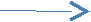
 Cl Cl—
Cl Cl—
1s22s22p63s23p5 1s22s22p63s23p6
 Ионная связь возникает между образовавшимися ионами лития Li+ и хлора Cl—. Понятно, что противоположно заряженные частицы притягиваются друг к другу и удерживаются за счёт сил электростатического притяжения. Весь механизм образования ионной связи можно показать в виде краткой схемы:
Ионная связь возникает между образовавшимися ионами лития Li+ и хлора Cl—. Понятно, что противоположно заряженные частицы притягиваются друг к другу и удерживаются за счёт сил электростатического притяжения. Весь механизм образования ионной связи можно показать в виде краткой схемы:
Li – 1e Li+ ионная связь
 Cl +1e Cl—
Cl +1e Cl—
Выполните! Задания, приведённые на обороте, выполните в тетради
Задание 4. (Выполните это задание, если вы находитесь на I варианте). Покажите образование ионной связи между атомами Na и S. Обратите внимание на количество электронов, которое отдаст натрий и на количество электронов, которое принимает сера…Одного атома натрия явно недостаточно…(Это была подсказка). После выполнения данного задания ответьте на вопросы:
Сколько атомов натрия необходимо взять для образования ионной связи между ним и серой? Почему?
Конфигурацию какого благородного газа принимает ион натрия?
Конфигурацию какого благородного газа принимает ион серы?
Объясните почему атом натрия отдает электроны? Почему атом серы принимает электроны?
Задание 5. (Выполните это задание, если вы находитесь на II варианте). Покажите образование ионной связи между атомами Na и N. Обратите внимание на количество электронов, которое отдаст натрий и на количество электронов, которое принимает азот…Одного атома натрия явно недостаточно…(Это была подсказка). После выполнения данного задания ответьте на вопросы:
Сколько атомов натрия необходимо взять для образования ионной связи между ним и азотом? Почему?
Конфигурацию какого благородного газа принимает ион натрия?
Конфигурацию какого благородного газа принимает ион азота?
Объясните почему атом натрия отдает электроны? Почему атом азота принимает электроны?
Задание 6. Изобразите схемы строения следующих ионов: Mg+2; O-2; Ca+2; F—. Запишите для них сокращенные электронные формулы и укажите, конфигурациям каких благородных газов соответствуют конфигурации данных ионов. Составьте формулы всех возможных соединений, которые могут быть образованы данными ионами.
Задание 7. Какие ионы могут иметь конфигурацию 1s22s22p6(электронная конфигурация атома неона). Приведите примеры не менее трёх катионов и трёх анионов.
Домашнее задание! Выучить тему «Ионная химическая связь». Подготовиться к с/р по темам «Электроотрицательность химических элементов», «Ковалентная химическая связь», «Ионная связь».
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Химия. Неорганическая химия. 8 класс: учебник для общеобразоват. учреждений/Рудзитис, Фельдман — 13е издание-М: просвещение, 2009- 176с
