Дата_____________ Класс_______________
Тема: Фосфор. Аллотропия и свойства.
Цели урока: знать строение, свойства и применение фосфора; уметь доказывать химические свойства фосфора, записывать уравнения реакций в свете представлений об электролитической диссоциации и окислительно-восстановительных процессах.
Ход урока
1. Организационный момент урока.
2. Изучение нового материала.
СТРОЕНИЕ АТОМА ФОСФОРА
Фосфор расположен в III периоде, в 5 группе главной подгруппе «А», под порядковым номером №15. Относительная атомная масса Ar(P) = 31.
Р +15)2 )8 )5
1S22S22P63S23P3, фосфор: p– элемент, неметалл
Валентные возможности фосфора шире, чем у атома азота, так как в атоме фосфора имеются свободные d-орбитали. Поэтому может произойти распаривание 3S2 – электронов и один из них может перейти на 3d– орбиталь. В этом случае на третьем энергетическом уровне фосфора окажется пять неспаренных электронов и фосфор сможет проявлять валентность V.
В свободном состоянии фосфор образует несколько аллотропных видоизменений: белый,красный и чёрный фосфор
Из -за большой химической активности фосфор в природе встречается только в виде соединений.
Нахождение в природе
Общее содержание фосфора в земной коре составляет 0,08%. В связанном виде он входит в состав многих минералов, главным образом апатитов 3Ca3(РО4)2 хСаF2 и фосфатов Са3(РO4)2. Разновидности апатита слагают осадочные горные породы — фосфориты, фосфор входит также в состав белковых веществ в виде различных соединений. Содержание фосфора в тканях мозга составляет 0,38%, в мышцах — 0,27%.
Самые богатые в мире залежи апатитов находятся близ г. Кировска на Кольском полуострове. Фосфориты широко распространены на Урале, в Поволжье, в Сибири, Казахстане, Эстонии, Белоруси и др. Большие месторождения фосфоритов имеются в Северной Африке, Сирии и США. Фосфор необходим для жизни растений. Поэтому почва всегда должна содержать достаточное количество соединений фосфора.
БИОЛОГИЧЕСКАЯ РОЛЬ СОЕДИНЕНИЙ ФОСФОРА
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·CaF2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800-1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Красный фосфор практически нетоксичен. Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50-150 мг. Попадая на кожу, белый фосфор дает тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2-3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе 0,03 мг/м³.
ПОЛУЧЕНИЕ ФОСФОРА
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
2Ca3(PO4)2 + 10C + 6SiO2 → P4 + 10CO + 6CaSiO3.
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
4HPO3 + 12C → 4P + 2H2 + 12CO.
| Восстановитель | |
| 1. С металлами — окислитель, образуетфосфиды: 2P + 3Ca → Ca3P2 Опыт «Получение фосфида кальция» 2P + 3Mg → Mg3P2. Фосфиды разлагаются кислотами и водой с образованием газа фосфина Mg3P2 + 3H2SO4(р—р)= 2PH3 + 3MgSO4 Опыт «Гидролиз фосфида кальция» Свойства фосфина — PH3 + 2O2 = H3PO4. PH3 + HI = PH4I | 1. Фосфор легко окисляется кислородом: «Горение белого фосфора под водой» «Сравнение температур воспламенения белого и красного фосфора» 4P + 5O2 → 2P2O5 (с избытком кислорода), 4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода). |
| 2. С неметаллами — восстановитель: 2P + 3S → P2S3, 2P + 3Cl2 → 2PCl3. ! Не взаимодействует с водородом. | |
| 3. Сильные окислители превращают фосфор в фосфорную кислоту: 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO; 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O. | |
| 4. Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль: 6P + 5KClO3 → 5KCl + 3P2O5 |
ПРИМЕНЕНИЕ ФОСФОРА
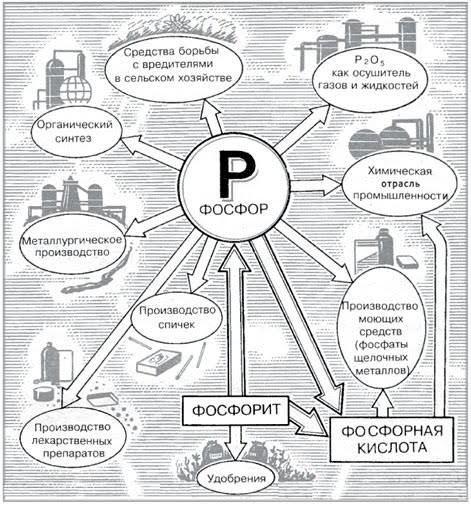
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности.
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробка, при трении спичечной головки в состав который входят хлорат калия и сера, происходит воспламенение. Так же красный фосфор используется при производстве взрывчатых веществ, зажигательных составов, топлив.
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, и др.
3. Закрепление изученного материала
№1. Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробка, при трении спичечной головки в состав который входят хлорат калия и сера, происходит воспламенение.
Происходит реакция :
P + KClO3 = KCl + P2O5
№2. Расставьте коэффициенты с помощью электронного баланса, укажите окислитель, и восстановитель, процессы окисления и восстановления.№1. Осуществите превращения по схеме:
P -> Ca3P2 -> PH3 -> P2O5
Для последней реакции PH3 -> P2O5 составьте электронный баланс, укажите окислитель и восстановитель.
№3. Осуществите превращения по схеме:
Ca3(PO4)2 -> P -> P2O5
4. Домашнее задание
П.21, упр.1-5, задачи 2,3 на стр.70
