Дата_____________ Класс_______________
Тема: Муравьиная и уксусная кислоты. Физические свойства. Применение.
Цели урока: рассмотреть карбоновые кислоты: муравьиная и уксусная кислоты,
Ход работы
1. Организационный момент урока.
2. Изучение нового материала
Карбоновые кислоты, класс органических соединений, содержащих карбоксильную группу (карбоксил)
1. Простейшие представители карбоновых кислот – муравьиная и уксусная кислоты.

Муравьиная кислота НСООН
Впервые муравьиная кислота была открыта в 1670 г. английским естествоиспытателем Джоном Реем в выделениях муравьев, откуда и пошло это название.
Муравьи дают людям муравьиную кислоту. Около 70% содержимого ядовитой железы рыжего муравья – это муравьиная кислота.
Рыжий муравей
Муравьиная кислота содержится также в листьях крапивы (вызывает ожоги), в хвое ели.
Издавна люди использовали муравьиную кислоту как средство для лечения ревматизма. Использовали весьма своеобразным способом. Люди, страдающие подагрой, засовывали ноги в муравейник и некоторое время терпели укусы его обитателей. Иногда использовали крапиву. В начале XVIII в. ученые научились вовлекать муравьиную кислоту в реакции с различными спиртами, получая вещества с узнаваемыми запахами. Например, в реакции фенилэтилового спирта и муравьиной кислоты получали вещество с запахом хризантем; при нагревании бензилового спирта с муравьиной кислотой получали вещество с запахом жасмина.
Муравьиная кислота находит широкое применение в различных отраслях народного хозяйства. В технике кислоту и ее соли применяют в качестве протравы при крашении тканей, в кожевенном производстве – для отмывания извести, используемой при обработке шкур. В медицине смесь кислоты с водой, так называемый муравьиный спирт, используется как раздражающее кожу, рефлекторно действующее средство при ревматических и неврологических болях. Муравьиная кислота применяется в промышленном органическом синтезе в качестве восстановителя, а также для получения щавелевой кислоты. В пищевой отрасли промышленности ее используют в качестве дезинфицирующего и консервирующего средства.
Сложные эфиры муравьиной кислоты используют в качестве растворителей и душистых веществ. Муравьиная кислота обладает хорошим бактерицидным действием.
Уксусная кислота СН3СООН
Из всех кислот
Она, конечно, прима,
Присутствует везде
И зримо, и незримо.
В животных и растениях есть она,
С ней техника и медицина навсегда.
Ее потомство – ацетаты –
Очень нужные «ребята».
Всем известный аспирин.
Он, как добрый господин,
Жар больного понижает
И здоровье возвращает.
Это – меди ацетат.
Он растеньям друг и брат,
Убивает их врагов.
От кислоты еще есть толк –
Нас одевает в ацетатный шелк.
А пельмени любит кто,
Знает уксус тот давно.
Есть еще вопрос кино:
Хорошо всем надо знать,
Что без пленки ацетатной нам кино не увидать.
Конечно, есть и другие применения,
И вам они известны, без сомнения.
Но главное, что сказано, друзья,
«Хлеб промышленности» уксусная кислота.
Уксусная кислота известна с древнейших времен (Китай, Египет, Вавилон) и была, очевидно, первой кислотой, которую узнал человек. Кислоту выделяли из уксуса, а последний получался при скисании вина. В 1648 г. немецкий химик И. Р. Глаубер обнаружил уксусную кислоту в подсмольной воде сухой перегонки дерева. В 1789 г. русский химик Т.Е.Ловиц впервые получил кристаллическую, так называемую ледяную уксусную кислоту. Ее химический состав был определен в 1814 г. шведским химиком Й. Я. Берцелиусом. Первый лабораторный синтез уксусной кислоты был осуществлен в 1845 г. немецким химиком А. В. Г. Кольбе.
Уксусная кислота широко распространена в природе. Она содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в частности, в зеленых листьях). Эта кислота встречается как в свободном виде, так и в виде солей и эфиров, она присутствует в кислом молоке и сыре.
Уксусная кислота – жидкость, кислая на вкус, с резким запахом. Безводная уксусная кислота плавится при +16,6 °С, ее кристаллы прозрачны как лед, отсюда название ледяная уксусная кислота. Обычная техническая уксусная кислота имеет концентрацию 70–80%. Температура кипения 100%-й уксусной кислоты – 118 °C. Смешивается во всех отношениях с водой, спиртом, эфиром, бензолом. Ледяная уксусная кислота хороший растворитель многих органических веществ. Концентрированные растворы уксусной кислоты при попадании на кожу вызывают ожоги.
Уксусную кислоту используют при консервации и как приправу к пище. Из уксусной кислоты синтезируют лекарства, соли, ацетатный шелк, фруктовые эссенции, растворители лаков, красители для тканей, средства борьбы с насекомыми и болезнями растений, стимуляторы роста растений.
Уксусный ангидрид применяется в производстве пластических масс, искусственного шелка, ацетанилида.
Из монохлоруксусной кислоты получают негорючую кинопленку, органическое стекло, пропускающее ультрафиолетовые лучи. В результате применения 2,4-дихлорфеноксиуксусной кислоты и ее солей на полях с зерновыми погибают только широколиственные сорняки, что используется при выращивании зерновых культур.
Подобно минеральным кислотам в водных растворах карбоновые кислоты диссоциируют на ионы и изменяют окраску индикаторов (среда кислая):
СН3СОOН ↔ СН3СОО – + Н+.
Как и минеральные кислоты, они взаимодействуют с металлами, основными оксидами, основаниями и солями слабых летучих кислот:
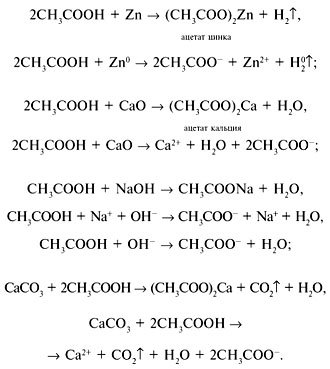
Высшие карбоновые кислоты – пальмитиновая и стеариновая кислоты.
СН3(СН2)14СООН, или С15Н31СООН – пальмитиновая кислота,
СН3(СН2)16СООН, или С17Н35СООН – стеариновая кислота.
Эти кислоты в виде сложных зфиров входят в состав жиров, поэтому их называют высшими жирными кислотами.
Мишель Эжен Шеврель совместно с А.Браконно установил, что большинство жиров состоит из стеарина и олеина, выделил стеариновую и пальмитиновую кислоты.
Пальмитиновая кислота – наиболее распространенная в природе жирная кислота, входит в состав глицеридов большинства животных жиров и растительных масел
(например, пальмовое масло содержит 39–47% пальмитиновой кислоты), а также в состав некоторых восков.
Пчелиный воск
Две вот эти кислоты,
Словно сестры-близнецы,
Вместе как они похожи,
И тверды, и белокожи.
Итак, это твердые вещества, белого цвета, нерастворимы в воде, умеренно растворимы в спирте, эфире, хлороформе и других органических растворителях. Температура плавления стеариновой кислоты +69,3 °С, температура кипения от 360 до 370 °С. Химические свойства жирных кислот имеют свои особенности. Окраска водных растворов индикаторов не изменяется при добавлении порошков пальмитиновой и стеариновой кислот.
Эти кислоты растворяются в водных растворах едких щелочей и карбонатов, образуя соли, которые являются спутниками человека всю жизнь. К таким веществам относится мыло. Вспомним с детства знакомые строки:
«Да здравствует мыло душистое
И полотенце пушистое!»
Натриевые и калиевые соли высших жирных кислот называют мылами. Они хорошо растворяются в воде, обладают моющим действием и составляют основу жидкого мыла (калиевые соли) и твердого мыла (натриевые соли). Водные растворы мыла имеют щелочную реакцию, т. к. соли подвергаются гидролизу.
Смесь пальмитиновой и стеариновой кислот используют для изготовления стеариновых свечей. Жирные кислоты превращают в соли и используют для получения различных мыл. Жидкое мыло (калиевые соли) по сравнению с твердым (натриевые соли) лучше растворимо в воде и поэтому обладает более сильным моющим действием.
Мыла имеют недостаток: они плохо моют в жесткой воде. Кроме того, щелочной характер мыла вреден для некоторых тканей. В связи с этим широко развивается производство синтетических моющих средств. Как и мыло, моющие средства обладают хорошим моющим действием и не утрачивают его в жесткой воде.
Другие карбоновые кислоты
Молочная CH3— CH(OH) – COOH
образуется при скисании молока, квашении капусты, силосовании кормов. Она отличный консервант.
Щавелевая HOOC—COOH содержится в щавеле
При нарушении обмена веществ в организме человека образуются камни в почках, представляющие собой оксалат кальция – соли щавелевой кислоты.
Щавелевую кислоту используют при производстве красителей и для удаления ржавчины.
Сложные эфиры.
При взаимодействии карбоновых кислот со спиртами образуются сложные эфиры:
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы. Приятный аромат цветов, плодов, ягод в значительной степени обусловлен присутствием в них тех или иных сложных эфиров.
Жиры
Жиры – это сложные эфиры глицерина и высших карбоновых кислот.
Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи. По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными. Жиры растворимы в органических растворителях и нерастворимы в воде.
Классификация жиров
Сложные эфиры используются как растворители, ароматизирующие добавки в парфюмерной, фармацевтической и пищевой отраслях промышленности. Жиры – основной источник энергии в живых организмах. При расщеплении 1 г жира освобождается существенно больше энергии, чем в случае белков и углеводов. Жировые прослойки выполняют структурные и защитные функции (жировые капсулы сердца, печени, почек), теплорегулирующую функцию (у животных – обитателей Севера и Антарктиды очень развита жировая подкожная прослойка). Жиры являются источником эндогенной воды (горб верблюда), выполняют гормональные функции, например жировую природу имеют половые гормоны. Витамины одного из классов называются «жирорастворимые», и жиры пищи способствуют усвоению этих витаминов (к ним относятся, например, витамины А и D). Жиры используются для производства мыла и глицерина.
3. Домашнее задание
