Дата ____________ Класс _____________
Тема: Слабые и сильные электролиты. Степень диссоциации
Цели урока: сформировать понятия о сильных и слабых электролитах, степени электролитической диссоциации, химическом равновесии.
Ход урока
1. Организационный момент урока.
№1. В какой группе все вещества являются оксидами?
А ) NaOH, P2O5, H2CO3
Б ) CO2, Na2O, FeO
В ) Na2SO4,CaO, SO2
Г ) Li2O, SiO2, H2SO3
№2. В какой группе все вещества являются основными оксидами?
А ) KOH, Ca(OH)2, CaO
В ) Na2O, Fe2O3,CrO
Г ) Na2O, CaO, MnO
Д ) P2O5,NaOH, HNO3
2. Степень электролитической диссоциации
Поскольку электролитическая диссоциация — процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Другими словами, различные электролиты, согласно теории С. Аррениуса, диссоциируют на ионы в различной степени. Полнота распада (сила электролита) характеризуется количественной величиной – степенью диссоциации.
Степень диссоциации (α – греческая буква альфа) — это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):
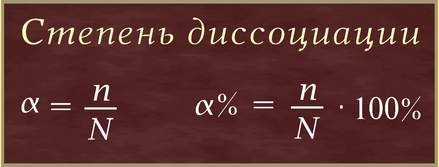
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
3. Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры.
1. Зависимость степени диссоциации от природы: чем полярнее химическая связь в молекуле электролита и растворителя, тем сильнее выражен процесс диссоциации электролита на ионы и тем выше значение степени диссоциации.
2. Зависимость степени диссоциации от концентрации электролита: с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от температуры: степень диссоциации возрастает при повышении температуры (повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы).
4. Сильные и слабые электролиты
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Сильные электролиты – это электролиты, которые полностью диссоциируют на ионы, молекул электролитов в таких растворах нет.
Слабые электролиты – это электролиты, которые в водных растворах не полностью диссоциируют на ионы. В таких растворах одновременно содержатся продукты диссоциации и ассоциации (ионы и молекулы электролита).
5. Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
| Сильные электролиты | Средние электролиты | Слабые электролиты | |
| Значение степени диссоциации (α) | α>30% | 3%≤α≤30% | α<3% |
| Примеры | 1. Растворимые соли; 2. Сильные кислоты (НСl, HBr, HI, НNО3, НсlO4, Н2SO4(разб.)); 3. Сильные основания – щёлочи. | H3PO4 H2SO3 | 1. Почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2. Некоторые неорганические кислоты (H2CO3, H2S и др.); 3. Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH); 4. Вода. |
6. Домашнее задание.
