Дата_____________ Класс_______________
Тема: Углекислый газ, угольная кислота и ее соли.
Цели урока: знать состав, строение, свойства и применение угольной кислоты и ее соли; знать качественную реакцию на карбонат-ион, круговорот углерода в природе.
Ход урока
1. Организационный момент урока.
2. Изучение нового материала.
Оксид углерода (IV) СO2 – углекислый газ
Физические свойства: Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение.
Строение молекулы:
Углекислый газ имеет следующие электронную и структурную формулы —
|
| O=C=O |
Все четыре связи ковалентые полярные.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
CaCO3 t=1200˚C→ CaO + CO2
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
CaCO3 (мрамор) + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HCl → NaCl + H2O + CO2
Способы собирания
|
вытеснением воздуха |
3. Сгорание углеродсодержащих веществ:
СН4 + 2О2 → 2H2O + CO2
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства:
Кислотный оксид:
1) с водой даёт непрочную угольную кислоту:
СО2 + Н2О ↔ Н2СО3
2) реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Na2O + CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 (избыток) → NaHCO3
3) При повышенной температуре может проявлять окислительные свойства – окисляет металлы — СO2 + Me = MexOy + C
С+4O2 + 2Mg t˚C→ 2Mg+2O + C
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
Ca(OH)2 + CO2 → CaCO3 ↓+ H2O
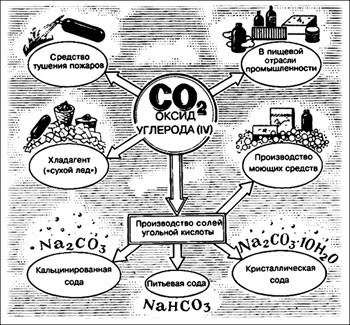
Угольная кислота и её соли
Химическая формула — H2CO3
Структурная формула – все связи ковалентные полярные:
![]()
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
CO2 + H2O ↔ H2CO3
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
Просмотр видео «Качественная реакция на карбанат-ионы»
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
H2CO3 ↔ H+ + HCO3—(гидрокарбонат-ион)
HCO3— ↔ H+ + CO32- (карбонат-ион)
2) с активными металлами
H2CO3 + Ca = CaCO3 + H2↑
3) с основными оксидами
H2CO3 + CaO = CaCO3 + H2O
4) с основаниями
H2CO3(изб) + NaOH = NaHCO3 + H2O
H2CO3 + 2NaOH = Na2CO3 + 2H2O
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
Средние соли — карбонаты Na2СO3, (NH4)2CO3
Кислые соли — бикарбонаты, гидрокарбонаты NaHCO3 , Ca(HCO3)2
В природе встречаются:
CaCO3
мел мрамор известняк



NaHCO3 – питьевая сода
K2CO3(поташ, в золе растений)
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 + H2O + CO2↑
3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO+ CO2↑
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Видео-опыт «гидрокарбонаты в карбонаты»
Me(HCO3)n + Me(OH)n → MeCO3+H2O
Me(HCO3)n t˚C → MeCO3↓+H2O+CO2↑
Видео-опыт «карбонаты в гидрокарбонаты»
MeCO3+H2O+CO2= Me(HCO3)n
Специфические свойства:
1) Качественная реакция на CO32- карбонат – ион «вскипание» при действии сильной кислоты:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
3. Закрепление изученного материала
№ 1. Закончите уравнения осуществимых химических реакций:
CO 2+ KOH =
CO + Al =
H2CO3+ K2SO4 =
CO2( изб ) + NaOH =
С O2+ Na2O =
CaCO3+ CO2 + H2O =
CO2+ Ca(OH)2 =
CO + CaO =
CO2+ H2SO4 =
Ca(HCO3)2+ Ca(OH)2=
H2CO3+ NaCl =
C + ZnO =
№2.
Осуществите превращения по схеме:
1) Al 4 C 3→ CH 4→ CO 2→ CaCO 3→ Ca ( HCO 3)2→ CaCO 3
2) Ca → CaC 2→ Ca ( OH )2→ CaCO 3→ CO 2→ C
3) CO2 → H2CO3 → Na2CO3 → CO2
4) CaCO3 → CO2 → NaHCO3 → Na2CO3
№3. Решите задачи
1.Какой объём углекислого газа выделится при обжиге карбоната кальция массой 200 г
2. Сколько угольной кислоты можно получить при взаимодействии 2 л углекислого газа (н.у.) с водой, если выход кислоты составил 90% по сравнению с теоретическим
4. Домашнее задание
П. 27-29, упр. 14-20, задача 3 на стр.91
