
 9 класс
9 класс
Урок-путешествие «Свойства серной кислоты»
Цели:
Образовательные – изучение химических свойств серной кислоты, закрепление навыков написания уравнений реакций по химическим свойствам; умений проводить опыты, доказывающие химические свойства серной кислоты, совершенствование навыков работы с лабораторным оборудованием.
Развивающие – развитие умений сравнивать свойства, развитие мотивации учебной деятельности, внимания, речи, мышления.
Воспитывающие – воспитание самостоятельности, сотрудничества, коллективизма, общительности.
Оборудование и реактивы:
На демонстрационном столе: H2SO4(К),Н2О, сахар, лучинка, 2 стакана, палочка, спиртовка, медная проволока. Название станций на доске.
На столах учащихся: H2SO4(р), Zn, CuO, NaOH(P) ф/ф, метилоранж, BaCl2, Na2SO4, спиртовка, 6 пробирок.
Ход урока
Вам сегодня предстоит увлекательное путешествие в страну серной кислоты. Но прежде, чем отправится в путь необходимо проверить вашу готовность.
Какую формулу имеет серная кислота?
Валентность кислотного остатка.
Определить степень окисления каждого химического элемента?
Остановка будет на следующих станциях:
Информационная
Демонстрационная
Экспериментальная
Проверочная
Подскажите мне, как вы думаете, что нас ждет на той или иной станции, что мы преследуем в нашем путешествии?
I Остановка – информационная.
H2SO4 стала известна химикам после XI в. В сочинениях Альберта Великого содержится упоминание о получение серной кислоты при нагревании железного купороса. “Купоросный спирт” “Купоросное масло” в России получали в небольших количествах в аптеках.
Вязкое, маслообразное, тяжелая жидкость r =1,84 г/см3, нелетучая при н.у., не имеет запаха (показывать H2SO4(К)).
Записать на доске структурную формулу
II Остановка – демонстрационная.
Познакомимся со специфическими свойствами H2SO4(К).
Опыт: растворение в воде кислоты.
ТБ: Кислоту приливают в воду осторожно!, выделится большое количество теплоты.
Первая помощь: Промыть струей воды, затем 5% раствором соды.
1 свойство:
Концентрированная H2SO4 поглощает из воздуха водяные пары с водой образуя гидраты
H2SO4 + n Н2О = H2SO4* nН2О + Q
2 свойство:
обугливание деревянной лучины (видео)
обугливание сахара (опыт)
С12Н22О11+ H2SO4 = 12С + H2SO4*11 Н2О + SO2
3 свойство:
Серная кислота реагирует с металлами, стоящими в ЭХРН после водорода (Cu, Hg, Ag)
Cu + 2H2SO4(K) = CuSO4 + SO2 + 2H2O
1 Cu – 2ē = Cu+2 восстановитель
1 S+6 + 2ē= S+4 окислитель
Опыт: Взаимодействие серной кислоты с медью при нагревании.
4 свойство:
Взаимодействие серной кислоты с металлами (кроме Al, Fe, Cr, Ni).
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
5 свойство
Окисление неметаллов
C + 2H2SO4 = CO2 + 2SO2 +2H2O
III остановка – экспериментальная
Изучение свойств разбавленной серной кислоты
Парная лабораторная работа по инструкциям (Инструкция прилагается).
Повторяем технику безопасности при работе с кислотами.
Уравнения реакций проверяем
V Остановка — проверочная “Самостоятельная работа”.
(задание на столе у каждого учащегося)
| 2 вариант | |
| Уровень А Напишите окислительно-восстановительную реакцию
| |
| Ag +H 2SO4(k)→ | Hg+H 2SO4(k)→ |
| Уровень В Допишите уравнения реакций (одну из реакций запишите в ионном виде) | |
| H 2SO4 (р) +Zn→ | H 2SO4 (р) +Fe→ |
| H 2SO4 +Na 2O→ | H 2SO4+CaO→ |
| H 2SO4 +Ca(OH)2→ | H 2SO4 +Na 2CO3→ |
| Уровень С С какими из веществ будет вступать в реакцию H 2SO4 (p): Напишите уравнения реакций, одну из реакций запишите в ионном виде | |
| CO2, KOH, Na 2CO3, Cu | Ca(OH)2,Hg,CuCl2,SO2
|
Д/З: п.28 (с.88-94) доклад (презентация) по теме «Соли серной кислоты»
Лабораторная работа (инструкция)
Изучение свойств серной кислоты и ее солей
Налейте в пробирку 2 мл раствора серной кислоты и исследуйте раствор индикаторами — метиловым оранжевым.
Опустите в одну пробирку с серной кислотой гранулу цинка. Что вы наблюдаете? Запишите уравнение реакции.
В пробирку насыпьте немного оксида меди(II),прилейте 2-3 мл раствора серной кислоты, слегка нагрейте. Напишите реакцию в ионном виде.
В пробирку налейте 1 мл р-ра гидроксида натрия, добавьте к нему раствор фенолфталеина, к раствору малинового цвета добавьте серной кислоты .Что вы наблюдаете? Запишите уравнение реакции в ионном виде.
Налейте в одну пробирку 2 мл раствора серной кислоты в другую 2 мл сульфата натрия, добавьте в обе пробирки по каплям раствор хлорида бария. Запишите уравнения реакций и цвет осадка.
Задания для самостоятельных выводов:
Как можно отличить серную кислоту от её солей?
Как отличить сульфаты от других солей.
Лабораторная работа (инструкция)
Изучение свойств серной кислоты и ее солей
Налейте в пробирку 2 мл раствора серной кислоты и исследуйте раствор индикаторами — метиловым оранжевым.
Опустите в одну пробирку с серной кислотой гранулу цинка. Что вы наблюдаете? Запишите уравнение реакции.
В пробирку насыпьте немного оксида меди(II),прилейте 2-3 мл раствора серной кислоты, слегка нагрейте. Напишите реакцию в ионном виде.
В пробирку налейте 1 мл р-ра гидроксида натрия, добавьте к нему раствор фенолфталеина, к раствору малинового цвета добавьте серной кислоты .Что вы наблюдаете? Запишите уравнение реакции в ионном виде.
Налейте в одну пробирку 2 мл раствора серной кислоты в другую 2 мл сульфата натрия, добавьте в обе пробирки по каплям раствор хлорида бария. Запишите уравнения реакций и цвет осадка.
Задания для самостоятельных выводов:
Как можно отличить серную кислоту от её солей?
Как отличить сульфаты от других солей.
Лабораторная работа (инструкция)
Изучение свойств серной кислоты и ее солей
Налейте в пробирку 2 мл раствора серной кислоты и исследуйте раствор индикаторами — метиловым оранжевым.
Опустите в одну пробирку с серной кислотой гранулу цинка. Что вы наблюдаете? Запишите уравнение реакции.
В пробирку насыпьте немного оксида меди(II),прилейте 2-3 мл раствора серной кислоты, слегка нагрейте. Напишите реакцию в ионном виде.
В пробирку налейте 1 мл р-ра гидроксида натрия, добавьте к нему раствор фенолфталеина, к раствору малинового цвета добавьте серной кислоты .Что вы наблюдаете? Запишите уравнение реакции в ионном виде.
Налейте в одну пробирку 2 мл раствора серной кислоты в другую 2 мл сульфата натрия, добавьте в обе пробирки по каплям раствор хлорида бария. Запишите уравнения реакций и цвет осадка.
Задания для самостоятельных выводов:
Как можно отличить серную кислоту от её солей?
Как отличить сульфаты от других солей.
| 2 вариант | |
| Уровень А Напишите окислительно-восстановительную реакцию
| |
| Ag +H 2SO4(k)→ | Hg+H 2SO4(k)→ |
| Уровень В Допишите уравнения реакций (одну из реакций запишите в ионном виде) | |
| H 2SO4 (р) +Zn→ | H 2SO4 (р) +Fe→ |
| H 2SO4 +Na 2O→ | H 2SO4+CaO→ |
| H 2SO4 +Ca(OH)2→ | H 2SO4 +Na 2CO3→ |
| Уровень С С какими из веществ будет вступать в реакцию H 2SO4 (p): Напишите уравнения реакций, одну из реакций запишите в ионном виде | |
| CO2, KOH, Na 2CO3, Cu | Ca(OH)2,Hg,CuCl2,SO2
|
| 2 вариант | |
| Уровень А Напишите окислительно-восстановительную реакцию
| |
| Ag +H 2SO4(k)→ | Hg+H 2SO4(k)→ |
| Уровень В Допишите уравнения реакций (одну из реакций запишите в ионном виде) | |
| H 2SO4 (р) +Zn→ | H 2SO4 (р) +Fe→ |
| H 2SO4 +Na 2O→ | H 2SO4+CaO→ |
| H 2SO4 +Ca(OH)2→ | H 2SO4 +Na 2CO3→ |
| Уровень С С какими из веществ будет вступать в реакцию H 2SO4 (p): Напишите уравнения реакций, одну из реакций запишите в ионном виде | |
| CO2, KOH, Na 2CO3, Cu | Ca(OH)2,Hg,CuCl2,SO2
|
| 2 вариант | |
| Уровень А Напишите окислительно-восстановительную реакцию
| |
| Ag +H 2SO4(k)→ | Hg+H 2SO4(k)→ |
| Уровень В Допишите уравнения реакций (одну из реакций запишите в ионном виде) | |
| H 2SO4 (р) +Zn→ | H 2SO4 (р) +Fe→ |
| H 2SO4 +Na 2O→ | H 2SO4+CaO→ |
| H 2SO4 +Ca(OH)2→ | H 2SO4 +Na 2CO3→ |
| Уровень С С какими из веществ будет вступать в реакцию H 2SO4 (p): Напишите уравнения реакций, одну из реакций запишите в ионном виде | |
| CO2, KOH, Na 2CO3, Cu | Ca(OH)2,Hg,CuCl2,SO2
|
Свойства серной кислоты
Структурная формула серной кислоты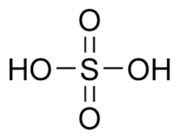
Физические свойства
Тяжелая маслянистая жидкость, плотность 1,84 г/см3
Нелетучая при н.у.
Не имеет запаха
Хорошо растворима в воде.
Химические свойства
Общие (лабораторный опыт) Специфические Растворение кислоты в воде Техника безопасности Первая помощь Концентрированная H2SO4 поглощает из воздуха водяные пары с водой образуя гидраты Обугливание А) деревянной лучины Б) сахара Взаимодействие с Ме А) стоящими в ЭХРН после (Н) – Cu, Hg, Ag Б) с Ме (кроме Al, Fe, Cr, Ni) Окисление неметаллов
АНАЛИЗ УРОКА
Урок химии в 9-ом классе по теме «Свойства серной кислоты».
Урок – введение нового материала.
Цели:
Образовательные – изучение химических свойств серной кислоты, закрепление навыков написания уравнений реакций по химическим свойствам; умений проводить опыты, доказывающие химические свойства серной кислоты, совершенствование навыков работы с лабораторным оборудованием.
Развивающие – развитие умений сравнивать свойства, развитие мотивации учебной деятельности, внимания, речи, мышления.
Воспитывающие – воспитание самостоятельности, сотрудничества, коллективизма, общительности.
Постановка темы и целей урока была осуществлена учащимися с помощью учителя.
Данный урок –проводится в рамках раздела«Неметаллы». Урок опирается на знания, умения и навыки учащихся, полученные в ходе изучения химии в 8 классе.
Данный урок позволяет закрепить у учащихся способность доказывать химические свойства вещества и его соединений, записывать уравнения реакций, проводить опыты, доказывающие эти свойства. Что пригодится при изучении других элементов и их соединений.
Содержание изучаемого материала соответствует программным требованиям (предъявляемым к знаниям учащихся средней общей школы).
Формы, методы и средства обучения выбраны в соответствии с содержанием и целями.
Урок проводится в форме путешествия. Применение игровых приемов способствует созданию необходимого эмоционального фона на уроке, дает возможность создать доверительную атмосферу с детьми и при этом добиваться поставленных целей.
Для достижения поставленных целей на уроке применялись:
Игровые приемы
Словесные (ученики формулируют и проговаривают ответ на вопрос), наглядные (таблица растворимости, видеосюжет, демонстрация опыта) и практические (проведение опытов) методы организации учебно-познавательной деятельности.
Методы самостоятельной, парной работы
Методы активизации познавательной деятельности – творческие, практические эксперементальные задания.
Урок строился на принципах развивающего обучения, то есть учитель играет роль организатора учебной деятельности учащихся, ученики являются полноценными участниками урока, развивая свою познавательную активность, творческие способности, самооценку.
Эффективность урока достигалась за счет использования различных форм организации деятельности учащихся:
Фронтальная работа (активизация изученного материала)
Парная работа (выполнение в паре практической работы )
Для проведения урока были созданы все необходимые условия:
Учебно-материальные – учебник, тетрадь, доска, таблица
Морально-психологические – на уроке установился эмоциональный контакт между учителем и учениками, была создана доброжелательная атмосфера
Гигиенические – кабинет убран, проветрен
Эстетические – оформление доски, тетради
Временные – сохранялся хронометраж урока, временные рамки соблюдены
