Тема урока:
Электролитическая диссоциация.
Цели урока:
1)Сформировать понятия об электролитах и неэлектролитах.
2)Рассмотреть механизм диссоциации веществ с ионной и ковалентной полярной связью.
3)Ввести понятие «степень электролитической диссоциации» и рассмотреть классификацию электролитов.
Оборудование и реактивы:
Компьютер, презентация, проектор, датчик электропроводности лаборатории L-Mikro, прибор для определения электропроводности с электрической лампочкой. Растворы кислот, щелочей, солей одинаковой концентрации, раствор сахара, спирт, ледяная уксусная кислота.
Ход урока.
Организационный момент.
Ученик читает стихотворение о химии. Слайд №6 .
В жизни химия нужна,
Как предмет она важна.
И учить ее прилежно
Мы должны от А до Я.
Что мы носим, что едим,
Чем здоровью мы вредим?
Как кислоты выливать,
Чтобы что-то не взорвать?
На все вопросы эти
Нам химия ответит!
Актуализация знаний.
Учитель задает вопрос:
Чем отличаются вещества с ионной и ковалентной связью?
Учащиеся отвечают, используя Слайд № 8
Вещества с ионной связью тугоплавкие, твердые, нелетучие, многие растворимы в воде. Это соли, щелочи.
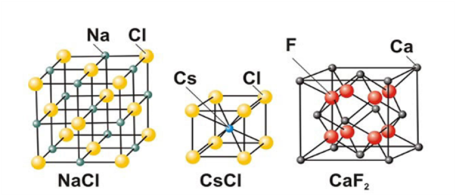
Отвечает следующий учащийся, используя Слайд №9.
Вещества с ковалентной связью легкоплавкие, небольшой твердости, часто газы или жидкости. Это йод, лед, «сухой лед», твердая HCL.
Их толочь не надо в ступке —
Так кристаллы эти хрупки.
Чуть-чуть нагреваются,
И тотчас испаряются.


Возгонка «сухой лед»
Йода
Изучение новой темы. Электролитическая диссоциация.
Учитель: Слайд №10 .
«Дождливый день. На остановке троллейбуса люди складывают зонтики и заходят в салон. Вот один из них поставил ногу на ступеньку и тут же отпрянул: «Ой, током бьет!»

Как же ток добрался до пассажира?
Сегодня, ребята, мы будем это выяснять.
Учитель:
Различия соединений с ионной и ковалентной связью проявляется также в особенностях их водных растворов.
Проводится демонстрационный опыт – измерение электропроводности различных веществ датчиком электропроводности лаборатории L—Mikro.
(результаты экспериментов мгновенно обрабатываются программой лаборатории L—Mikro и отражаются в графическом виде на кране через проектор).
Учитель:
Ребята, у меня в руках прибор, измеряющий электропроводность растворов. Называется он «датчик электропроводности».
Я погружаю его в дистиллированную воду. Что вы наблюдаете?
Учащиеся отвечают:
Линия остается на нуле, т.к. дистиллированная вода не проводит ток.
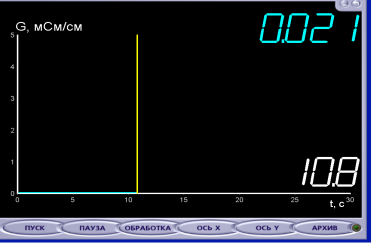 Электропроводность дистилированной воды
Электропроводность дистилированной воды
Учитель:
Испытаем на электропроводность водопроводную воду. Посмотрите на показания датчика. Что вы наблюдаете?
Электропроводность водопроводной воды.
Учитель:
Испытаем на электропроводность кристаллы поваренной соли и щелочи.
Что вы наблюдаете?
Учащиеся наблюдают, что кристаллы так же не проводят ток.
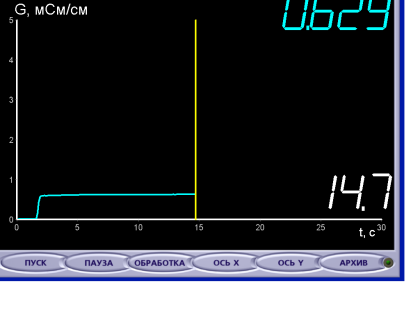
Учитель растворяет кристаллы соли в дистиллированной воде и тщательно перемешивает раствор.
Ребята, Что происходит?
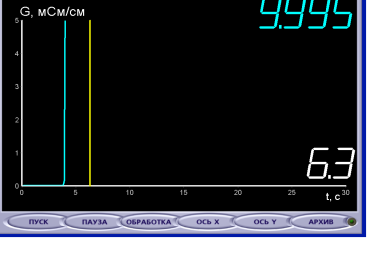
Учащиеся: кривая резко «поползла» наверх, т.к. электропроводность возросла после растворения соли в воде.
Учитель:
Давайте испытаем на электропроводность разные химические вещества: кислоты, соли, щелочи. Органические вещества (спирт, сахар, ледяная уксусная кислота).
Учащиеся во время демонстрационного эксперимента заполняют таблицу, которую подготовил учитель для каждого учащегося. (Приложение № 1).
Учитель: на основании проделанных опытов попробуйте сформулировать определения электролитов.
Учащиеся выдвигают свои формулировки определений, наиболее удачные записываются в тетради.
Определение:
Электролит – вещество, раствор которого проводит электрический ток.
Учитель:
Какие вещества, проводящие электрический ток вы еще знаете?
Учащиеся:
Металлы!
Учитель:
Ребята, вспомните, почему металлы проводят ток?
Учащиеся:
Благодаря свободным электронам в кристалле металла.
Учитель:
Почему растворы некоторых веществ могут проводить ток?
Учащиеся выдвигают гипотезы, предположения:
Значит, в растворах электролитов тоже есть свободно двигающиеся заряженные частицы.
Учитель:
Какие частицы?
Учащимся не трудно догадаться, что в соединениях с ионной связью такими частицами являются ионы.
Был придуман забавный стишок, позволяющий запомнить заряд ионов:
Для двух ребят подарков груз
ИОН взвалил себе на спину:
Для КАТИ ОН несет свой плюс,
Для АНИ ОН несет свой минус.
Учащиеся записывают в тетрадях:
Катион – частица имеющая положительный заряд,
Анион — частица, имеющая отрицательный заряд.
Учащийся подготовил сообщение о строении молекулы воды (диполя воды), используя — Слайд № 18.
Учитель:
Ионы в кристаллах не свободные, находятся строго в узлах кристаллической решетки. При растворении в воде солей и щелочей происходит разрушение кристаллической решетки, и ионы становятся свободными, т. е. способными к перемещению. Поэтому водные растворы ионных соединений проводят ток. В растворах кислот, а которых связь ковалентная полярная, при растворении в воде ковалентная полярная связь переходит в ионную, и образовавшиеся ионы обусловливают электропроводность растворов.
Учащиеся записывают определение:
Распад вещества на ионы при растворении в воде называется электролитической диссоциацией.
Учитель:
Диссоциация означает – распад, разъединение. Диссоциация называется электролитической потому, что в результате образуются растворы электролитов.
Металлы – это проводники первого рода ( ток переносится электронами).
Проводники второго рода – это электролиты ( ток переносится ионами).
Немного истории. Презентация: Слайды №26,27,28,29.
Учитель демонстрирует эксперимент с прибором для определения электропроводности:
Деви и Фарадей проводили опыты по определению электропроводности растворов, используя специальный прибор. Если вещество проводит ток, то лампочка загорается, если не проводит — не загорается. Впервые объяснил это явление шведский химик Сванте Аррениус в 1887 году.
Сообщение ученика:
В 1887 году Сванте Аррениус приезжает в Лейпциг к Вильгельму Оствальду, профессору местного университета, чтобы продолжить исследования, начатые в Риге. Новые теории и перспективы поработать с крупнейшими европейскими химиками привлекли сюда И.А.Каблукова. Около года ученые работали вместе. в результате их исследований появилась стройная теория. Однако Аррениусу не удалось полностью раскрыть процесс электролитической диссоциации. Он не учитывал роль молекул растворителя и полагал, что в водном растворе находятся свободные ионы. Его работу продолжили другие ученые.
При изучении процессов гидратации, у ученых возник вопрос, с какими частицами реагирует вода? Ответить на этот вопрос помогла гидратная теория растворов Менделеева. И.А. Каблуков, а затем и В.А. Кистяковский независимо друг от друга предположили, что с молекулами воды реагируют ионы электролитов, т.е. происходит гидратация ионов. Каблуков положил начало физико-химической теории растворов в 1889-1891 годах. Кистяковский в 1888 году высказал идею об объединении химической теории растворов Менделеева и учении Аррениуса об электролитической диссоциации
Учащиеся записывают в тетради:
Сущность гидратной теории состоит в том, что в рассмотрении растворов учитывалось взаимодействие растворенного вещества с молекулами растворителя.
Слайд № 22.
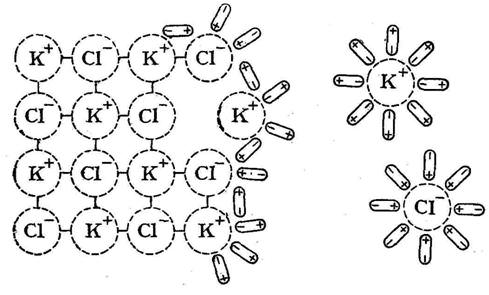
Механизм процесса диссоциации: Анимация в презентации: Слайды № 23, № 24
Учащиеся записывают в тетради:
Процесс электролитической диссоциации для веществ с ионной связью состоит из следующих этапов:
Ориентация молекул-диполей воды вокруг ионов электролита.
Гидратация молекул воды с ионами поверхностного слоя кристалла.
Диссоциация электролита на гидратированные ионы.
Процесс электролитичекой диссоциации для веществ с ковалентной полярной связью состоит из следующих этапов:
Ориентация
Гидратация
Ионизация
Диссоциация.
Учитель:
-Как при помощи химических формул и знаков записывать процесс диссоциации хлорида калия, сульфата натрия? Обратите внимание на индексах в формулах веществ.
Учащиеся записывают самостоятельно диссоциацию веществ, один ученик работает у доски.
KCL=K+ + CL— Na2SO4=2Na+ + SO42-
Учитель:
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации. Зная, что в растворе присутствуют и ионы и молекулы, как вы можете сформулировать определение степени диссоциации?
Учащиеся выдвигают свои определения:
Степень диссоциации (а) – это отношение числа частиц, распавшихся на ионы (NД), к общему числу растворенных частиц (NР).
Учащиеся сами выводят формулу степени диссоциации:
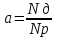
Учитель: Если а=0, то диссоциация отсутствует, если а=1, или 100%, то электролит полностью распадается на ионы. Это зависит то природы электролита.
Учитель:
Ребята, посмотрите на показания датчика электропроводности. Почему значения электропроводности разные у различных веществ? Как вы думаете?
Учащиеся выдвигают свои предположения:
Вещества с высокими показаниями электропроводности содержат больше заряженных частиц.
Учитель:
Совершенно верно, ребята. Различают сильные и слабые электролиты.
Заполняем таблицу.
| Слабые электролиты, степень диссоциации стремится к нулю. | |
| Растворимые соли | Слабые кислоты (H2S, H2CO3, HNO2) |
| Сильные кислоты (H2SO4, HCL, HNO3) | Водный раствор аммиака (NH3*H2O) |
| Все щелочи (NaOH, KOH) |
|
Рефлексия. Проводится небольшая игра «Кто быстрее?».
Учащиеся делятся на 3 команды, каждой команде раздаются карточки.
Первое задание: распределить вещества по своим колонкам (электролиты и неэлектролиты).
Второе задание: написать полное молекулярное уравнение по сокращенному ионному.
Карточки см. в приложении №2.
V. Выводы.
Ребята, давайте вспомним про человека в троллейбусе. Каким образом ток добрался до пассажира?
Учащиеся отвечают на вопрос без затруднений. Вода с растворенными в ней веществами проводит электрический ток.
Итоги урока.
Выставление отметок.
Домашнее задание. Параграф №35, упр. 1-6.
Приложение № 1.
| Вещество проводит электрический ток (электролит) | Вещество не проводит электрический ток (неэлектролит) | |
| Дистилированная вода |
| — |
| Водопроводная вода | + |
|
| Раствор поваренной соли (NaCL) | + |
|
| Раствор соляной кислоты (HCL) | + |
|
| Спирт (C2H5OH) |
| — |
| Крислаллы поваренной соли |
| — |
| Раствор сахара |
| — |
| Раствор гидроксида натрия | + |
|
Приложение №2.
| Неэлектролиты | |
|
|
|
За 2 минуты написать по сокращенным ионным уравнениям молекулярные уравнения, расставить коэффициенты:
Cu2++S2-=CuS↓
Ba2++SO42-=BaSO4↓
Карточка для команды № 2.
1.За 1 минуту выписать из перечня веществ электролиты и неэлектроиты:
Ba(OH)2, H2SO4, ZnCL2, HCL, CaO, KNO3, NaOH, O2, спирт, AL(OH)3.
| Неэлектролиты | |
|
|
|
2.За 2 минуты написать по сокращенным ионным уравнениям молекулярные уравнения, расставить коэффициенты:
MgO+2H+=Mg2++H2O
CO32-+2H+=CO2↑+H2O
Карточка для команды № 3.
1.За 1 минуту выписать из перечня веществ электролиты и неэлектроиты:
AgCL, CuSO4, H2SiO3, HNO3, RbOH, FeO, CuO, KOH,сахар, K2SO4.
| Неэлектролиты | |
|
|
|
За 2 минуты написать по сокращенным ионным уравнениям молекулярные уравнения, расставьте коэффициенты:
Fe3++3OH—=Fe(OH)3↓
2H++S2-=H2S↑
