
/8 класс/

Тема урока: Обобщение знаний об основных типах химических реакций.
Цель: Обобщить и закрепить знания о типах химических реакций.
Оборудование и реактивы: периодическая система химических элементов Д.И.Менделеева, самодельные таблицы и схемы, Малахит – Сu2(ОН)2 СО3, Р – фосфор, СuSO4 – раствор сульфат меди (II), Fe – железо, NaOH – гидроксид натрия, НСl – соляная кислота, фенолфталеин, лакмус, прибор для разложения малахита.
Ход урока.
Организационный момент, вступительное слово учителя о целях урока.
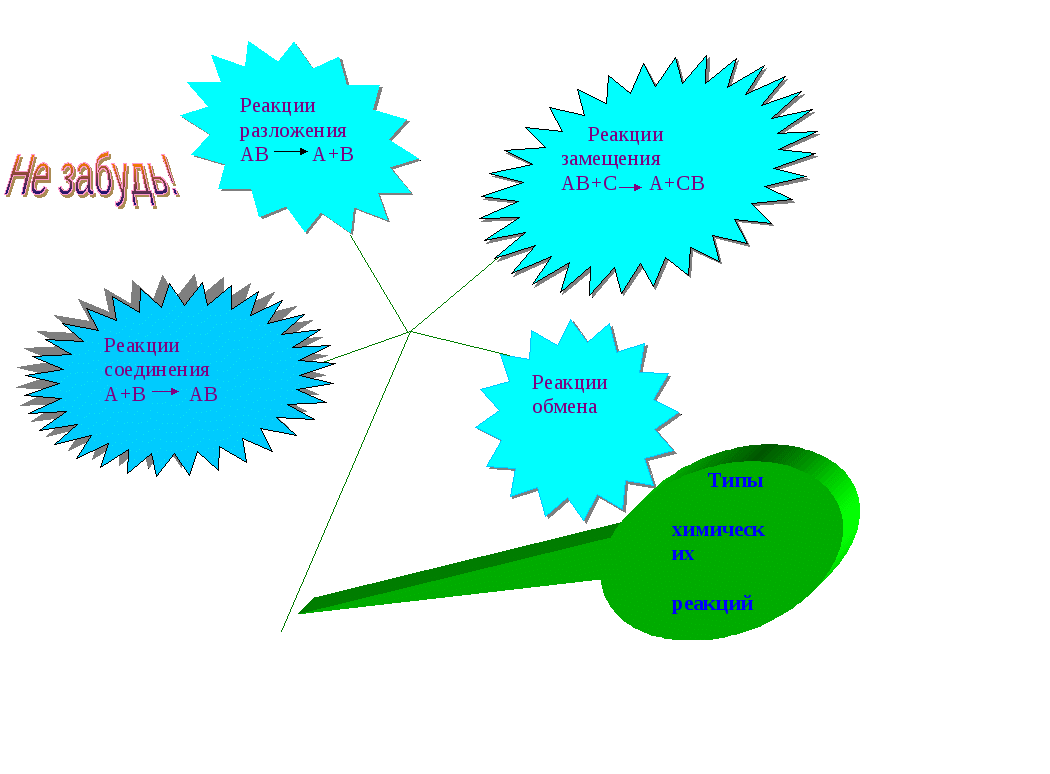
Отгадываем тему урока. На доске следующие схемы (см. приложение). Какое отношение эти схемы имеют к химии, к теме урока? Учащиеся дают различные ответы. Учитель обобщает сказанное и называет тему урока. Учащиеся записывают тему урока в тетрадях.
Повторяем определение – типов химических реакций:
Какие реакции называются реакциями соединения?
Какие реакции называются реакциями разложения?
Какие реакции называются реакциями замещения?
Какие реакции называются реакциями обмена?
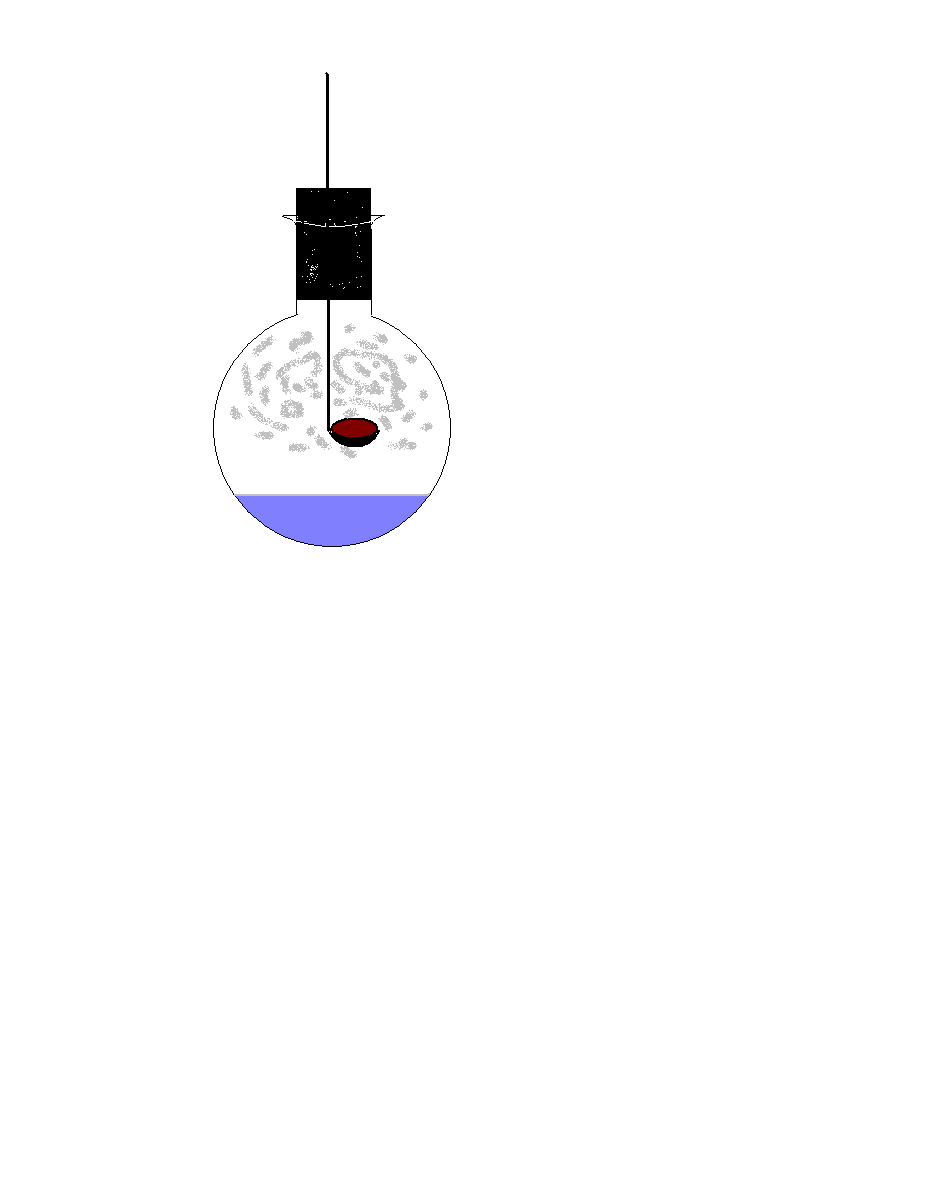
Практическое задание. Проведите реакцию разложения малахита (прибор для опыта заранее собран).
Перед тем, как учащиеся начнут выполнять опыт, учитель напоминает
основные правила техники безопасности.
Выполнение опыта по инструкции (инструкция у каждого учащегося на
столе).
Анализ опыта:
а) Что было?
б) Что получилось? Какие вещества?
в) Признаки реакции.
г) Почему пробирку надо держать в наклонном
положении?
д) Реакция экзотермическая или
эндотермическая?
е) Почему эту реакцию называют разложением?
Запись в тетрадях учащихся.
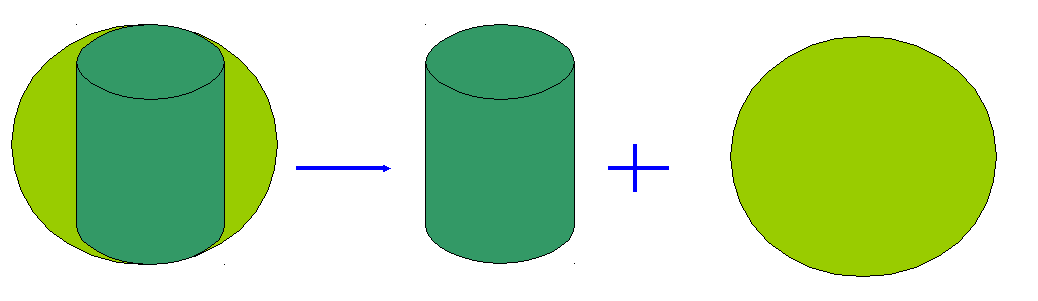
Реакция разложения
С u2(ОН)2 СО3 2СuО + Н2 О + СО2
u2(ОН)2 СО3 2СuО + Н2 О + СО2
Исходное вещество одно – Сu2(ОН)2 СО3
Продуктов реакции три – СuО, Н2О, СО2
В ходе опыта наблюдали: а) выделение газа,
б) изменение цвета,
в) образование капелек воды.
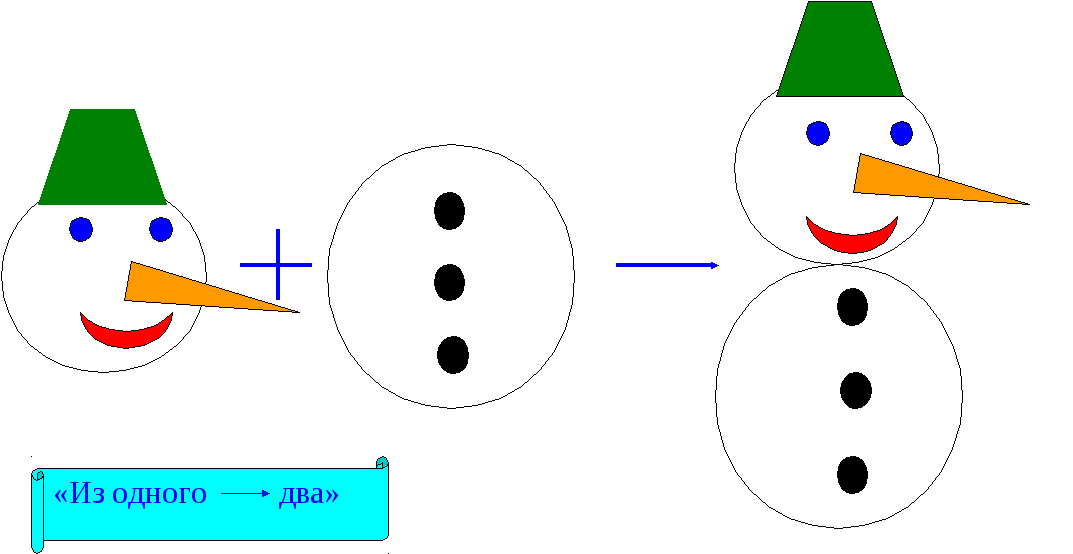
В ывод: Из одного несколько.
ывод: Из одного несколько.
Реакция соединения.
Учитель показывает учащимся опыт:
а) горение фосфора
б) взаимодействие оксида фосфора (V) c водой.
 Оксид фосфора(V)
Оксид фосфора(V)
 Фосфор
Фосфор
 Вода + лакмус
Вода + лакмус
Демонстрационный эксперимент.
Беседа по анализу опыта:
Какие две реакции соединения я вам показал?
Какой признак первой реакции?
Какой признак второй реакции?
Запись в тетрадях учащихся
Реакция соединения
4 Р + 5О2 2 Р2 О5
Р + 5О2 2 Р2 О5
Р 2 О5 +3 Н2 О 2 Н3 РО4
2 О5 +3 Н2 О 2 Н3 РО4
Опыт № 1. Наблюдали: выделение тепла и света, «белый дым» —
Р2 О5
Исходные вещества: фосфор (Р) и кислород (О2)
Продукты реакции: Р2 О5 — оксид фосфора (V).
Опыт № 2. Наблюдали: изменение окраски лакмуса
Исходные вещества: Р2 О5 — оксид фосфора (V), Н2 О – вода.
Продукты реакции: Н3 РО4 – ортофосфорная кислота.
В ывод: Из нескольких одно.
ывод: Из нескольких одно.
Реакция замещения.
Практическое задание. Проведите реакцию замещения между железом и сульфатом меди (II)
Выполнение опыта (по указанию учителя).
Анализ опыта: а) Что брали?
б) Что наблюдали?
в) Назовите продукты реакции.
Запись в тетрадях учащихся
Р еакция замещения Fe + СuSO4 Fe SO4 + Сu
еакция замещения Fe + СuSO4 Fe SO4 + Сu
Наблюдали: осаждение меди на железном гвозде, изменение цвета раствора
Исходные вещества: Fe и СuSO4
Продукты реакции: Fe SO4 + Сu
Вывод: Атомы простого вещества замещают атомы в сложном веществе.
На доске помещаем обобщающую таблицу в форме незабудки.
Четвертый тип химических реакций мы будем изучать немного позже и дорисуем нашу незабудку.
Подводятся итоги. Выставляются оценки, отмечается работа некоторых учащихся.