Урок химии, 8 класс (базовый уровень)
Учитель : Серебрякова Елена Васильевна
МОУ СОШ № 9,г.Георгиевска
Тема урока: Реакции обмена
Задачи:
Ход урока
Организационный момент: приветствие, проверка явки учащихся, заполнение журнала.
Проверка готовности учащихся к уроку: настрой учащихся на работу, доведение до них плана урока.
Сегодня на уроке, мы продолжим изучение типов химических реакций . и изучим новый тип – это реакции обмена.
Мы с вами будем работать в технологических картах, которые лежат у вас на парте. В графе фамилия и имя подпишите свою фамилию и имя.
Обратите внимание на оценочную таблицу, в графе домашнее задание вы сами поставите отметки за сделанное дома упражнение, в графе диктант отметку вам поставит ваш товарищ, и в конце урока вы сдадите свои карты и я поставлю вам итоговую отметку за урок.
Но прежде чем начать работу, мы проверим домашнее задание.
Откройте тетради с домашним заданием.
На дом вам задавали параграф 31, упр 2 а и б.
Давайте проверим, правильно ли вы выполнили упражнение. На доске у нас слайд с правильным ответом. ученик проверяет своего товарища и отмечает правильность выполнения в рабочей карте урока.
Давайте вспомним, какие реакции вы уже знаете?
Соединения
Замещения
разложения
Актуализация знаний, подготовка к восприятию нового материала.
А сейчас мы проведем диктант. Найдите слово диктант и задание 1. Я читаю задания, а вы записываете ответы в технологических картах
Запишите уравнения следующих реакций
Хлорид меди(II) + алюминий→
Кальций + соляная кислота→
Расставьте коэффициенты:
2Al + H2SO4→Al2(SO4)3+H2
4P+5O2→P2O5
Вставьте пропущенное слово:
5.Реакции, в результате которых из одного сложного вещества образуются два и более новых веществ – это ….разложение
6. Реакции, в результате которых из одного или нескольких исходных веществ образуется одно сложное вещество – это…..соединения
Слайд с правильными ответами
А теперь обменяйтесь технологическими картами и ваш сосед по парте проверит правильность выполнения задания.
Если ошибок нет , то отметка 5
Если 1 ошибка , то отметка 4
Если 2 ошибки, то отметка 3
В конце урока вы технологические карты сдадите и отметки будут выставлены в журнал
Изучение нового материала: Класс предварительно делится на группы по 4 человека .У каждой группы на парте набор реактивов для проведения опытов и карточки задания для отработки написания уравнений реакций
Учителю помогают сильные ученики .которые есть в каждой группе,(их выбирает учитель)
Сегодня на уроке мы с вами продолжим изучение химических реакций и познакомимся с новым типом – это реакции обмена.
Давайте посмотрим на доску.
Чем отличаются эти реакции?
2 Fe+ 3Cl2= 2FeCl3
2HgOà2Hg+O2
Fe+CuSO4=FeSO4+Cu
CaCO3 + 2HCl = CaCl2 + H2CO3 Слайд
К какому типу реакций они относятся?
Нам еще не знакома эта реакция и сегодня на уроке мы с вами изучим тип этой реакции.
Реакции обмена — это такие реакции, в результате которых два сложных вещества обмениваются своими составными частями.
AB+CD = AC+BD
Например, 2NaI+Pb(NO3)2 = PbI2↓ + 2NaNO3
Задание:
Fe(NO3)3 + 3NaOH= Fe(OH)3 + 3NaNO3
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3 Слайд
А сейчас мы посмотрим опыт.
Реакции протекающие с выпадением осадка
1. Возьмем пробирку
2. нальем раствор хлорида меди (II) и добавим раствор гидроксида натрия.
Что наблюдаете?
Выпадает густой синий осадок нерастворимого в воде гидроксида меди (II).
А теперь уберем учебники и тетради на край стола, пододвинем лотки с реактивами и выполним аналогичный опыт на местах.
Но сначала мы вспомним правила техники безопасности.
Т. б.
Не спеши хватать пробирку,
А инструкцию читай.
Убедись, что ты все понял,
Вот тогда и начинай.
Это, друг, химкабинет,
Для еды условий нет.
Пусть в пробирке пахнет воблой,
В колбе — будто мармелад.
Вещества на вкус не пробуй!
Сладко пахнет даже яд.
Всякое в опыте может случиться,
Внимательным будь и не оплошай.
Тебе всегда поможет учитель,
Паники только не допускай!
Ты сливал, нагревал реактивы
И отчет подготовил в тетрадке.
Не забудь вымыть руки с мылом,
Чтоб здоровье было в порядке
2NaOH + CuCl2 = Cu(OH)2 ↓+ 2NaCl Слайд
В результате проведенной реакции два сложных вещества ионного строения – щелочь и соль – обменялись своими ионами, т.е. произошла реакция обмена.
А теперь давайте возьмем чистую пробирку, нальем раствор щелочи и добавим несколько капель фенолфталеина.
Что мы наблюдаем?
Содержимое пробирки окрасилось в малиновый цвет, что свидетельствует о щелочной среде раствора. Если же теперь к содержимому пробирки прилить немного раствора кислоты, окраска исчезнет, раствор обесцветится, что является признаком химической реакции.
Обратите внимание, взаимодействуют два сложных вещества: щелочь, состоящая из ионов металла и гидроксид — ионов и кислота – молекулярное соединение, которое в растворе образует ионы водорода и кислотного остатка. В итоге образуются два новых сложных вещества: ионное соединение – соль и молекулярное – вода.
В каждом из двух взаимодействующих растворов была своя среда, соответственно щелочная и кислотная. В результате реакции среда стала нейтральной. Поэтому
Реакции нейтрализации – это реакции обмена между кислотами и щелочами.
KOH+ H2SO4 = K2SO4 + H2O
А теперь мы вновь вернемся к опытам две пробирке нальем раствор карбоната натрия и прильем раствор кислоты. Что мы наблюдаем?
В результате реакции выделяется газ.
Если подержать над отверстием пробирок влажную лакмусовую бумагу, то она покраснеет, а это значит, что в растворе у нас кислая среда.
Теперь проведем аналогичный опыт с реактивами и напишем уравнения реакций.
Na2CO3 + 2HCl = 2NaCl + H2CO3 слайд
А где же газ?
Угольная кислота – непрочное соединение, которое распадается на углекислый газ и воду:
H2CO3 = H2O + CO2↑
Поэтому уравнение реакции следует записать так:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑слайд
С примером реакций обмена, которые протекают с выделением газа мы с вами встречались на кухне.
Можете привести пример?
Когда гасим соду уксусом при выпечке.
На основе сделанных опытов сформулируем правило, согласно которому протекают реакции обмена между растворами веществ.
Реакции обмена, протекающие в растворах, идут до конца только в том случае, если в результате их образуется осадок, газ или вода. слайд
Стих – слайд
Если выделится газ — Это раз;
И получится вода — Это два;
А еще — нерастворимый
Осаждается продукт…
«Есть осадок» — говорим мы.
Это третий важный пункт.
Химик правила обмена
Не забудет никогда:
В результате — непременно
Будет газ или вода,
Выпадет осадок — Вот тогда — порядок!
Показать:
Е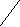 сли к раствору хлорида натрия прилить раствор гидроксида калия, то никаких признаков реакции не будет – реакция не идет, так как в результате ее не образуется ни осадка, ни газа, ни воды:
сли к раствору хлорида натрия прилить раствор гидроксида калия, то никаких признаков реакции не будет – реакция не идет, так как в результате ее не образуется ни осадка, ни газа, ни воды:
NaCl + KOH = NaOH+KCL
Для того чтобы знать какие реакции идут до конца, а какие нет, нужно обратиться к таблице растворимости , которая находится на форзаце учебника ( по вертикали располагаются анионы, а в горизонтальной строке располагаются катионы) – реакция идет лишь в том случае, если образуется осадок или газ. И NaOH и КСl растворимы, следовательно реакция не протекает до конца).
Какие из реакций обмена будут протекать до конца?Ребята работают по группам с консультантами одноклассниками
BaCl2 + 2AgNO3→Ba(NO3)2+2AgCl↓
C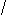 u(NO3)2 + NaCl→CuCl2+NaNO3
u(NO3)2 + NaCl→CuCl2+NaNO3
Pb(NO3)2 + K2S→PbS↓+2KNO3
M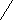 gCl2 + K2SO4→MgSO4+KCL
gCl2 + K2SO4→MgSO4+KCL
H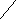 NO3 + ZnSO4→H2SO4+Zn(NO3)2
NO3 + ZnSO4→H2SO4+Zn(NO3)2
3Ca(NO3)2 +2 H3PO4→Ca3(PO4)2↓+6HNO3
Ba(NO3)2 + Na2SO4→BaSO4↓+2NaNO3
А чтобы узнать какие реакции будут протекать до конца, мы воспользуемся таблицей растворимости гидроксидов и солей в воде. Эта таблица находится на форзаце учебника.
Итоги урока: сегодня на уроке мы с вами изучили новый тип реакции – реакции обмена.
Провели лабораторную работу.
Сформулировали правило, согласно которому протекают реакции обмена между растворами веществ.
Домашнее задание
обязательное: прочитать §32, задание № 1 на стр. 167;
дополнительное: задание № 2 на стр. 168;
творческое: создать презентацию на тему «Реакции обмена».
Литература:
Габриелян О.С. химия 8 класс. – М.: Дрофа, 2008.
Габриелян О.С., Березкин П.Н., Ушакова А.А. химия. 8 класс: контрольные и проверочные работы к учебнику Габриелян О.С., химия 8 класс. – М.: Дрофа, 2007 .
Габриелян О.С., Воскобойников Н.П., Яшукова А.В. химия 8 класс. Настольная книга учителя. – М.: Дрофа, 2007 .
Учебное электронное издание химия (8 – 11 класс). Виртуальная лаборатория.
7
