













































 Модульное изучение темы «Кислородсодержащие органические соединения».10 класс
Модульное изучение темы «Кислородсодержащие органические соединения».10 класс
Цель: создание условий для выявления учащимися взаимосвязи между свойствами веществ на примере кислородсодержащих органических соединений.
Задачи: создать условия для использования исследовательского метода;
способствовать развитию интеллектуальных умений (сравнение, анализ, аналогия, установление причинно-следственных связей),рефлексивных умений, навыков само- и взаимоконтроля, культуру монологической речи и представления результатов работы.
УЭ-. Вводный контроль.(1ч)
Цель: проверить уровень сформированности знаний учащихся о классификации, номенклатуре и строение кислородсодержащих органических соединений.
Тест
Соединение состава СН3СН2СНО называется
а) пропионовая кислота
б) пропанол
в) пропаноль
г) пропанон
Вещества, имеющие формулы СН3-О-СН3 и СН3-СН2-ОН, является
а) гомологами
б) полимерами
в) структурными изомерами
г) пространственными изомерами
3. Число 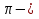 и
и 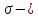 связей в молекуле уксусной кислоты соответственно равно
связей в молекуле уксусной кислоты соответственно равно
а) 2 и 7 б) 1 и 5 в) 2 и 6 г) 1 и 7
4.Продуктом гидратации бутена-1 является
а) одноатомный спирт
б) многоатомный спирт
в) альдегид
г) кетон
5.Не может являться спиртом вещество, формула которого
а) С2Н4О2
б) С3Н8О
в) С3Н8О2
г) С4Н10О2
6.Все валентные углы равны между собой в молекуле
а) этаналия
б) пропаналя
в) пропанона
г) бензальдегида
7.В состоянии sp2— гибридизация находятся все атомы углерода в молекуле
а) пропанона
б) пропаналя
в) пропеналя
г) этаналя
(Ответы: 1в, 2б, 3г, 4а, 5а, 6г, 7в.)
Учащиеся выполняют задания в течение 10 мин, сверяют ответы с эталоном, каждый правильный ответ оценивают 1 баллом, затем проводят итоги в соответствии со шкалой: 0-4 балла – необходимо повторить классификацию и номенклатуру органических соединений; 5-7 баллов – можно изучать тему «Кислородсодержащие органические соединения».
Соответственно с учащимися составляем на доске схему «Классификация кислородсодержащих соединений».
Классификация кислородсодержащих органических соединений
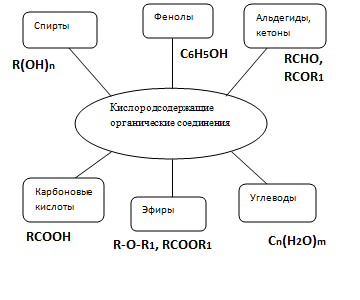
Затем выдаю каждому ученику контрольный лист, в котором указаны все виды работ, и разъясняю, что в него будут выставляться результаты самооценки и/ или взаимооценки, а также оценки учителя. Затем учащиеся делятся на группы по 4-5 человек.
УЭ-2. Взаимосвязь строения и свойств кислородсодержащих органических соединений (1ч)
Цель: создание условий для выявления учащимися взаимосвязи между строением и свойствами кислородсодержащих органических веществ.
Задачи: создать условия для изучения физических свойств кислородсодержащих веществ;
развивать умения при работе с текстом учебника и химическими веществами;
воспитывать объективную самооценку, организационные навыки и навыки самостоятельной работы.
Ход урока
Для актуализации знаний проводим химический диктант.
Химический диктант
Вариант 1
Общая формула сложных эфиров.
Межклассовый изомер этанола.
Структурная формула 2,3-диметилпентаналя.
Назовите вещество по формуле:
СН3 — СН — СН — СН3
СН3 ОН
Структурная формула представителя класса карбоновых кислот.
Вариант 2
Общая формула спиртов.
Изомер бутанола-1, отличающийся положением функциональной группы.
Структурная формула 2,2-диметилгексановой кислоты
Назовите вещество по формуле:
СН3 — СН — СН — СН3
ОН ОН
Структурная формула представителя класса простых эфиров.
Учащиеся выполняют задания в течение 5 мин, затем сверяют ответы с эталоном, выставляют по 1 баллу за каждый правильный ответ.
После этого переходим к анализу строения органических веществ.
Модели молекул каких веществ изображены на рисунке?
Что между ними общего?
Предположите, какие свойства характерны для этих соединений. Почему?
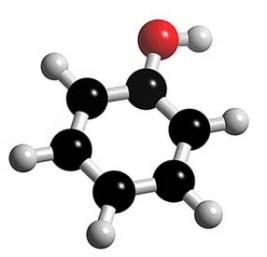
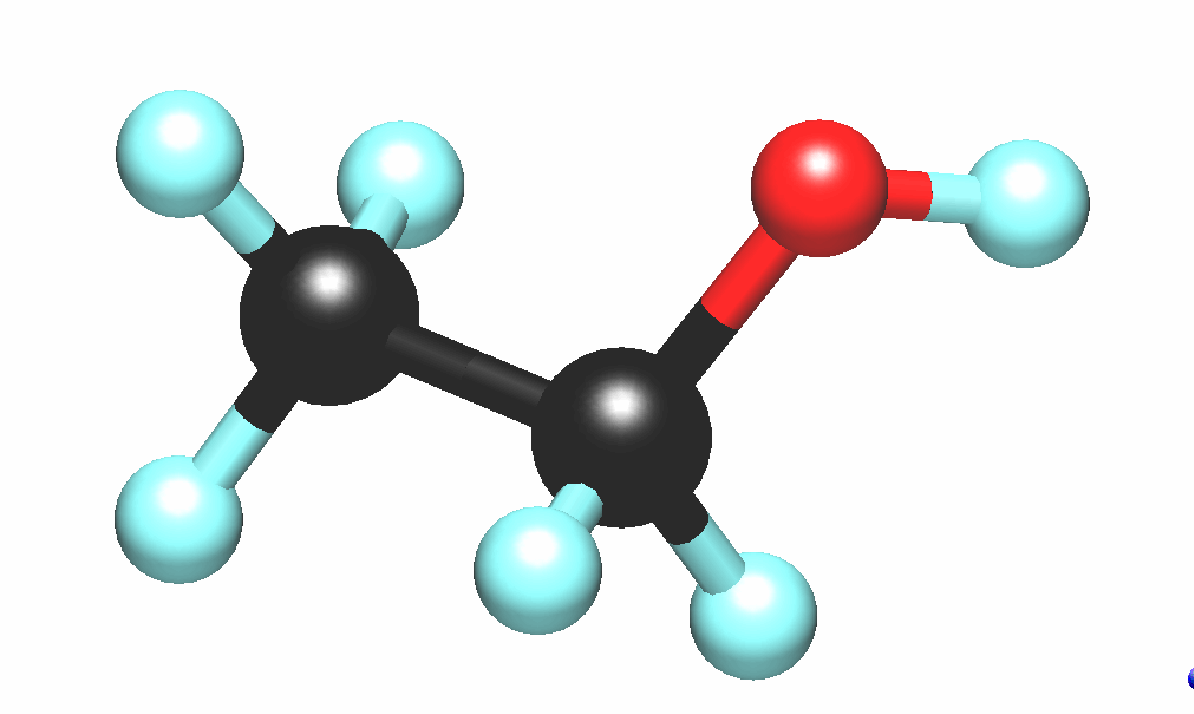
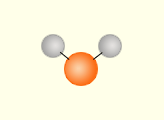
Предлагаем учащимся по данным, приведённым в табл. 1, выявить закономерность и объяснить её.
Свои предположения учащиеся должны подтвердить экспериментально, работая в группах.
Таблица 1
Сравнение характеристик некоторых органических веществ
| Молярная масса, г/моль | tкип,˚С | |
| Пропан | 44 | -42 |
| Этанол | 46 | 78 |
| Бутан | 58 | |
| Пропанол-1 | 60 | 97 |
| Уксусная кислота | 60 | 118 |
| Этандиол | 62 | 197 |
| Пентан | 72 | 35 |
| Диэтиловый эфир | 74 | 35 |
| Бутаналь | 72 | 76 |
| Бутанол-1 | 74 | 118 |
| Пропионовая кислота | 74 | 141 |
На столах учащихся находятся образцы органических веществ: этанола, глицерина, уксусной кислоты, глюкозы. Школьники исследуют их физические свойства и заполняют табл.2.
Результат работы по заполнению таблицы учащиеся представляют в группах и заполняют контрольные листы.
Таблица 2
Физические свойства некоторых неорганических веществ
| Формула | Агрегатное состояние | Растворимость в воде | Запах | Вкус | Наличие водородных связей | |
| Фенолы | С6Н5ОН |
|
|
|
|
|
| Спирты | R(ОН)n |
|
|
|
|
|
| Альдегиды | RCHO |
|
|
|
|
|
| Карбоновые кислоты | RCOOH |
|
|
|
|
|
| Сложные эфиры | R1COOR2 |
|
|
|
|
|
| Углеводы | Cn(H2O)m |
|
|
|
|
|
Домашнее задание. Для всех: пользуясь учебником ( Габриелян О.С. Химия. 10 класс. – М.: Дрофа, 2010, §9), запишите уравнения химических реакций, отражающих свойства одноатомных спиртов.
Для желающих: предположите, какие свойства могут проявлять соединения, формулы которых приведены ниже. Напишите уравнения возможных реакций.
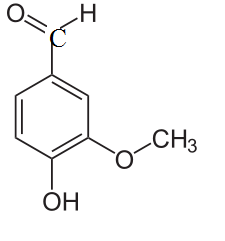
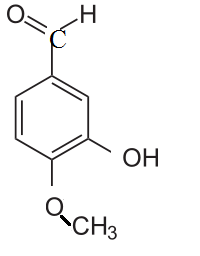
ванилин изованилин.
УЭ-3. Экспериментальный блок. Химические свойства кислородсодержащих органических соединений (2ч)
Цели: создание проблемной ситуации и нахождение условий для решения проблемы.
Задачи: создать условия для усвоения учащимися химических свойств кислородсодержащих соединений;
развивать исследовательские умения, навыки при составление уравнений химических реакций, отражающих химические свойства веществ;
воспитывать объективную самооценку, организационные навыки и навыки самостоятельной работы
Ход урока
Учащиеся выполняют практическую работу в парах, используя карточки-инструкции.
Карточка-инструкция к практической работе.
Оборудование: спиртовка, спички, штатив с приборами, пробиркодержатель, тигельные щипцы, карбоновые кислоты (уксусная, стеариновая, акриловая, лимонная), этанол, растворы глицерина, глюкозы, гидроксида натрия, сульфата меди (II), серной кислоты, перманганата калия, индикатора, карбонат кальция, магний, медь (проволока), оксид кальция.
Сформулируйте цель и проведите реакции в соответствии с инструкцией.
В пробирки с этанолом и глицерином добавьте свежеприготовленный гидроксид меди (II). Что наблюдаете?
В растворы уксусной кислоты, глюкозы и этанола поместите кусочки магния. Что наблюдаете?
В пробирку с этанолом опустите раскалённую медную проволочку. Что наблюдаете?
К растворам глицерина и глюкозы добавьте свежеприготовленный гидроксид меди (II). Что наблюдаете? Затем обе пробирки нагрейте. Что наблюдаете?
К растворам уксусной и серной кислот добавьте: а) кусочек мела или мрамора; б) магний; в) оксид кальция. Что наблюдаете? Сравните результаты испытаний.
К раствору лимонной кислоты в разных пробирках добавьте: а) кусочек мела или мрамора; б) магний; в) оксид кальция. Что наблюдаете? Сравните результат с предыдущем опытом.
К раствору акриловой кислоты добавьте раствор перманганата калия. Что наблюдаете?
Заполните таб. 3
Таблица 3
| Уравнения реакций | Наблюдения | |
|
|
|
|
Ответьте на вопросы.
Почему при взаимодействии спиртов, фенола и карбоновых кислот с магнием выделяется водород?
Почему при взаимодействии глицерина и глюкозы со свежеприготовленныйм гидроксидом меди (II) образуется синий раствор, а при нагревании красный осадок выпадает только в пробирке с раствором глюкозы?
Какие реакции можно считать качественными на кислородсодержащие органические соединения? Почему? Выпишите из учебника уравнения этих реакций.
Какие свойства карбоновых кислот (физические и химические) можно считать общими свойствами кислот?
В чем причина Различий в свойствах карбоновых кислот?
Запишите вывод.
Обсуждаем результаты эксперимента, учащиеся оформляют отчёты и заполняют контрольные листы.
Домашнее задание. 1. На конкретных примерах проиллюстрируйте генетическую связь классов органических веществ:
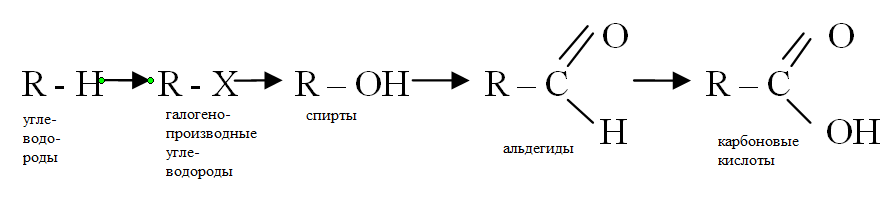
На примере 2-3 кислородсодержащих соединений покажите, как связано строение веществ с их свойствами.
УЭ-4. Теоретический блок. Составление опорных конспектов (2ч)
Цель :обобщение и систематизация знаний о химических свойствах и получении кислородсодержащих органических веществ.
Задачи: создать условия для самостоятельного, отбора и обобщения необходимых сведений о химических свойствах и получении кислородсодержащих органических веществ;
развивать умения самостоятельно составлять опорные конспекты, культуру монологической речи и логичное изложение результатов работы;
воспитывать объективную самооценку, организационные навыки и навыки работы в группах.
Ход урока
Демонстрируем учащимся опорный конспект по теме «Спирты».
Учащиеся работают в группах- составляют опорные конспекты по темам «Фенолы», «Альдегиды и кетоны», «Карбоновые кислоты», «Сложные эфиры и жиры», «Углеводороды».
По окончании отведенного времени группы представляют результаты работы,, обсуждением их. Школьники заполняют контрольные листы.
Домашнее задание. Для всех: выучите конспекты, § 9-13 напишите уравнения химических реакций, характеризующих химические свойства кислородсодержащих органических соединений на примере конкретных веществ ( пропаналь, пропионовая кислота, рибоза).
Для желающих: подготовить мультимедийную презентацию о применении кислородсодержащих органических соединений.
Опорный конспект по теме «Спирты»
Классификация
СН3ОН (метанол) Предельные Одноатомные С2Н5ОН(этанол)
СН2=СН — ОН Непредельные R(OH)n Многоатомные СН2ОН — СН2ОН
С6Н5 — СН2 — ОН Ароматические (этандиол)
|
R(OH)n | Химические свойства | |
|
H+ R-CH= СН2+H2O |
+Na R-ONa+ H2 | Замещение водорода в гидроксильной группе |
| H2SO4 R-CH= СН2+H2O t>170˚С | Внутримолекулярная дегидратация | |
| Cr2O3 2H2+CO метанол 400˚С
C6H12O6 2С2Н5ОН+2СО2
| H2SO4 R-O-R+H2O t>170˚С | Межмолекулярная дегидратация |
| +СН3СООН СН3СООR+ H2O Н+ | Этерификация | |
| Ni R-CHO+ H2 | [O] RCHO+ H2O |
Окисление |
| +NaOH R-Cl+ H2O | +HCl R-Cl+ H2O H2SO4 | Взаимодействие с галогеноводородами |
Качественная реакция на многоатомные спирты:
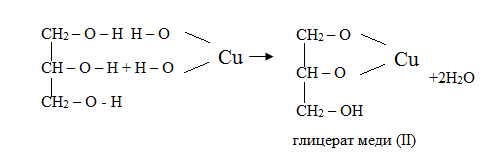
УЭ-5. Блок применения. Семинар — практикум по теме (1ч)
Цель: обобщение и систематизация ЗУН по теме: « Кислородсодержащие вещества»
Задачи: проверить уровень усвоения материала;
развивать умения при решении задач по уравнению химических реакций, при составле ние уравнений реакций, отражающих химические свойства и способы получения кислородсодержащих веществ.
воспитывать само- и взаимоконтроль.
Учащиеся работают индивидуально, выполняя разноуровневые задания, начиная с самого лёгкого.
Уровень 1
Назовите вещества, укажите, к каким классам они относятся.
Вариант 1
а) СН3 — СН — СН — СН3;
ОН ОН
б) СН3 — СН2 — СН — СН2 — СН — СН3;
ОН СН3
СН3
в) СН3 — СН — СН — С – СООН;
СН3 СН3 СН3
Вариант 2
а) СН3 — СН2 — О — СН2 — СН2 — СН3;
б) СН3 — СН2 — СН — СН2 — СНО;
СН3
в) СН3 — СН2 — СОО — СН2 — С 6Н5;
Напишите уравнения возможных реакций и укажите условия их протекания.
Вариант 1
а) СН3ОН +Na ;
б) СН3СООН+СО2 ;
в) С2Н5ОН+СuO ;
Вариант 2
а) СН3 – СН= СН2+ H2O ;
б) СН3 — СНО+СuO ;
в) С2Н5 – СНО + Cu(OH)2 ;
Уровень 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения, укажите условия протекания реакций.
Вариант 1
СаС2 Х СН3СНО С2Н5ОН СН3СНО СН3СООН
СН3СООСН3.
Вариант 2
СН4 С2Н2 Х С6Н5Cl С6Н5 — СН3 С6Н5 — СООН С6Н5 – СООCН3
Уровень 3
Вариант 1
Определите объем газа, который выделится при взаимодействии 40 г карбида алюминия, содержащего 5% примесей, с 120 мл воды, если потери газа составляют 15%.
Вариант 2
Определите массу глюконовой кислоты, которая получится при действии 20 г гидроксида меди (II) на 35 г глюкозы, содержащей 8% примесей, если выход продукта составляет 80%.
В конце урока учащиеся заполняют контрольные листы.
Домашнее задание. 1. Напишите уравнения реакций, с помощью которых можно осуществить превращения, определите вещества Х1 – Х8:
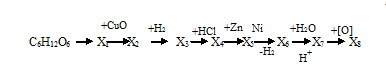
2. Определите массу 12%-ного раствора кислоты, которую можно получить при молочнокислом брожении 50 г глюкозы, содержащей 10% примесей.
3.Приведите структурные формулы всех возможных веществ состава С4Н8О2. Какие физические и химические свойства могут быть характерны для этих веществ?
УЭ- 6. Выходной контроль. Контрольная работа (1ч)
Цель: проверить уровень сформированности знаний учащихся.
Инструкция для учащихся
Тест состоит из частей А, В и С.На его выполнение отводится 40 мин. Рекомендуется выполнять задания по порядку. Если задание не удается выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям.
Вариант 1
Часть А
К каждому заданию части А даны несколько ответов, из которых только один верный. Выберите верный, по вашему мнению, ответ.
А1. НЕ МОЖЕТ ЯВЛЯТЬСЯ СПИРТОМ ВЕЩЕСТВО СОСТАВА
С2Н2О4 3) С2Н6О2
С2Н6О 4) С5Н12О2
А2. ЧИСЛО ИЗОМЕРНЫХ КАРБОНОВЫХ КИСЛОТ СОСТАВА С5Н10О2 РАВНО
двум 3) четырем
трем 4) пяти
А3. СПИРТ НЕ ОБРАЗУЕТСЯ ПРИ ВЗАИМОДЕЙСТВИИ С ВОДНЫМ РАСТВОРОМ ЩЁЛОЧИ
1,2-дибромбутана
1,3-дибромбутана
2,2-дибромбутана
1,4-дибромбутана
А4. ДЛЯ ПОЛУЧЕНИЯ АЦЕТАЛЬДЕГИДА ОКИСЛЯЮТ
этан 3) пропанол
этанол 4) этандиол
А5. ПРИ ОБЫЧНЫХ УСЛОВИЯХ УСТОЙЧИВ
этенол 3) пропандиол-2,2
метандиол 4) бутандиол-2,3
А6. В МОЛЕКУЛЕ МЕТАНОЛА
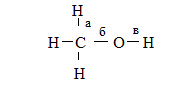
![]()
ПОЛЯРНОСТЬ КОВАЛЕНТНЫХ СВЯЗЕЙ ВОЗРАСТАЕТ В ПОСЛЕДОВАТЕЛЬНОСТИ
а, б, в 3) б, а, в
а, в, б 4) в, а, б
А7. СРЕДИ ПЕРЕЧИСЛЕННЫХ ВЕЩЕСТВ: а) метанол; б) 2,2-диметилпропанол-1; в) фенол; г) 2,4,6-трибромфенол – КИСЛОТНЫЕ СВОЙСТВА УСИЛИВАЮТСЯ В РЯДУ
а, б, в, г 3) б, а, г, в
б, а, в, г 4) в, г, а, б
А8. ИЗ ПЕРЕЧИСЛЕННЫХ СОЕДИНЕНИЙ САМЫЕ СИЛЬНЫЕ КИСЛОТНЫЕ СВОЙСТВА ПРОЯВЛЯЕТСЯ
2-хлорпропанол-1
3-хлорпропанол-1
2-бромпропанол-1
3-бромпропанол-1
А9. НАЛИЧИЕМ В МОЛЕКУЛАХ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ ДВОЙНОЙ СВЯЗИ ОБУСЛОВЛЕНА РЕАКЦИЯ
присоединения
разложения
замещения
обмена
А10. ВОССТАНАВЛИВАЮТСЯ ВОДОРОДОМ ВСЕ СОЕДИНЕНИЯ ГРУПП
формальдегид, ацетон, этиленгликоль
бутаналь, метанол, пентанон-2
ацетальдегид, бензальдегид, пентанон-3
бутанон, пропаналь, глицерин
А11. ПРИ НАГРЕВАНИИ АЦЕТАЛЬДЕГИДА С ГИДРОКСИДОМ МЕДИ (II)
растворяется осадок
выделяется газ
изменяется цвет осадка
внешних признаков реакции не наблюдается
Часть В
Ответом на задания части В может быть целое число, слово или формула.
В1. УСТАНОВИТЕ СООТВЕТСТВИЯ МЕЖДУ НАЗВАНИЕМ ВЕЩЕСТВА И ЧИСЛОМ π-связей В ЕГО МОЛЕКУЛЕ.
Название вещества Число π-связей в молекуле
А) Стирол 1) 0
Б) Бутандиол-1,2 2) 1
В) Пропаналь 3) 2
Г) Ацетилен 4) 3
5) 4
| Б | В | Г | |
|
|
|
|
|
Ответ: ______________________
В2. УСТАНОВИТЕ СООТВЕТСТВИЕ МЕЖДУ РЕАГЕНТАМИ И ТИПОМ РЕАКЦИИ.
РЕАГЕНТЫ ТИП РЕАКЦИИ
А) С2Н2 + Н2О 1) Гидролиз
Б) СаС2 + Н2О 2) Гидратация
В) СН3СООН + СН3ОН 3) Гидрирование
Г) СН3СНО + Н2 4) Этерификация
5) Галогенирование
| Б | В | Г | |
|
|
|
|
|
Ответ:______________________
В3.В СХЕМЕ ПРЕВРАЩЕНИЙ:
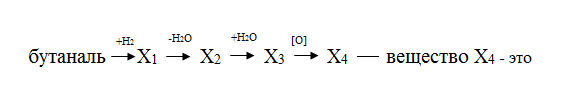
Часть С
С1. НАЙДИТЕ ОБЪЕМ ВОДОРОДА, КОТОРЫЙ ВЫДЕЛИТСЯ ПРИ ВЗАИМОДЕЙСТВИИ 34 г 20%-НОГО РАСТВОРА ФЕНОЛА И 5 г натрия.
Вариант 2
Часть А
К каждому заданию части А даны несколько ответов, из которых только один верный. Выберите верный, по вашему мнению, ответ.
А1. ЧИСЛО ВТОРИЧНЫХ СПИРТОВ, ИМЕЮЩИХ ФОРМУЛУ С5Н12О, РАВНО
двум
трем
четырем
пяти
А2. ОБЩАЯ ФОРМУЛА ПРЕДЕЛЬНЫХ ОДНООСНОВНЫХ КАРБОНОВЫХ КИСЛОТ
СnH2n+2O2
СnH2n-2O2
СnH2nO2
СnH2nO2
А3. НЕ ЯВЛЯЮТСЯ ИЗОМЕРАМИ
пентановая и 2-метилбутановая кислоты
пропановая кислота и метилацетат
пропионовая кислота и 2-гидроксипропаналь
масляная кислота и бутандион
А4. КЛАСС УГЛЕВОДОРОДОВ, ЛЮБОЙ ПРЕДСТАВИТЕЛЬ КОТОРОГО ПРИ ВЗАИМОДЕЙСТВИИ С ВОДОЙ ПРЕВРАЩАЕТСЯ В СПИРТ – ЭТО
алканы
алкены
алкины
алкадиены
А5. УКСУСНЫЙ АЛЬДЕГИД ОБРАЗУЕТСЯ ПРИ ГИДРАТАЦИИ
этана
этена
этина
этанола
А6. С ПОМОЩЬЮ АММИАЧНОГО РАСТВОРА ОКСИДА СЕРЕБРА НЕЛЬЗЯ РАСПОЗНАТЬ
этанол и этаналь
пропаналь и пропанон
пропаналь и глицерин
бутаналь и 2-метилпропаналь
А7. РЕАКЦИЕЙ КУЧЕРОВА НЕЛЬЗЯ ПОЛУЧИТЬ
этаналь
пентаналь
пентанон-2
пентанон-3
А8. ВСЕ ВАЛЕНТНЫЕ УГЛЫ РАВНЫ МЕЖДУ СОБОЙ В МОЛЕКУЛЕ
бутаналя
пропаналя
бутанона
метаналя
А9. ДИМЕТИЛКЕТОН, АЦЕТОН, ПРОПАНОН – ЭТО НАЗВАНИЯ
изомеров
гомологов
разных веществ
одного и того же вещества
А10. ЧИСЛО АТОМОВ ВОДОРОДА В МОЛЕКУЛЕ БЕНЗОЙНОЙ КИСЛОТЫ РАВНА
четырем
пяти
шести
семи
А11. В СОСТОЯНИИ sp2-ГИБРИДИЗАЦИИ НАХОДЯТСЯ ВСЕ АТОМЫ УГЛЕРОДА В МОЛЕКУЛЕ
ацетальдегида
ацетона
пропаналя
пропеналя
Часть В
Ответом на задания части В может быть целое число, слово или формула
В1. УСТАНОВИТЕ СООТВЕТСТВИЕ МЕЖДУ НАЗВАНИЕМ ВЕЩЕСТВА И ЧИСЛОМ АТОМОВ КИСЛОРОДА В ЕГО МОЛЕКУЛЕ.
НАЗВАНИЕ ВЕЩЕСТВА ЧИСЛО АТОМОВ КИСЛОРОДА
А) Фенол 1) 0
Б) Бутандиол-1,2 2) 1
В) Пропаналь 3) 2
Г) Толуол 4) 3
5) 4
| Б | В | Г | |
|
|
|
|
|
Ответ:_____________________
В2. УСТАНОВИТЕ СООТВЕТСТВИЕ МЕЖДУ ФОРМУЛОЙ И НАЗВАНИЕМ ВЕЩЕСТВА.
ФОРМУЛА НАЗВАНИЕ ВЕЩЕСТВА
А) СН3СН2СООН 1) Метилацетат
Б) С6Н5ОН 2) Пропановая кислота
В) СН3СООСН3 3) Пропаналь
Г) СН3СН2СНО 4) Фенол
5) Пропанол – 1
| Б | В | Г | |
|
|
|
|
|
Ответ:________________________
В3. СУММА ВСЕХ КОЭФФИЦИЕНТОВ ВО ВСЕХ УРАВНЕНИЯХ РЕАКЦИЙ, СООТВЕТСТВУЮЩИХ ЦЕПОЧКЕ ПРЕВРАЩЕНИЙ
МЕТАН Х1 Х2 УКСУСНАЯ КИСЛОТА, равна _____________
Часть С
С1. Найдите массу эфира, который можно получить при взаимодействии 23 г 70%-ной уксусной кислоты и 43 г 40%-ного раствора этанола.
УЭ-7. Аналитический блок. Анализ результатов работы над проблемным модулем (1ч)
Цель: обобщить результаты работы по теме «Кислородсодержащие органические соединения».
Ход урока
В начале урока проводим анализ типичных ошибок, допущенных в контрольной работе. Затем учащиеся представляют мультимедийные презентации по теме «Применение кислородосодержащих органических веществ». Организуем их обсуждение.
На этапе рефлексии предлагаем учащимся закончить предложения.
— Наибольшие затруднения у меня вызвало ….
— Больше всего мне понравилось ….
— Я научился (лась) …
Домашнее задание. 1. Напишите уравнения реакции получения: а) глюкозы из метана; б) метана из глюкозы; в) всех возможных эфиров (назовите их) из двух любых карбоновых кислот и двух предельных одноатомных спиртов. 2. Составьте и решите расчетную задачу по уравнению реакции с участием кислородосодержащих органических соединений.
