Рубаник Анна Иосифовна
учитель биологии и химии
МБОУ «СОШ№14»,г. Нижневартовск
Дифференцированный подход в обучении химии
Одной из перспективных и эффективных педагогических технологий обучения является дифференцированный подход обучения школьников, основанный на личностно-ориентированном характере образования. Цель дифференциации — обучение каждого на уровне его возможностей, способностей, адаптации обучения к особенностям различных групп учащихся.
Задания уровня «А» зафиксированы как базовый стандарт – минимальный, или репродуктивный. Здесь особенностью обучения является многократность повторения, умение выделять смысловые группы. Задание уровня «А» должен уметь выполнить каждый, прежде чем приступить к заданиям «В», «С». Уровень «В» – аналитико-синтетический уровень, руководствуется приемами умственной деятельности, которые необходимы для решения задач на применение. Здесь, кроме конкретных знаний вводятся дополнительные сведения, расширяющие материал уровня «А». Уровень «С» – творческий уровень, выводящий учащихся на уровень осознанного, творческого применения знаний, предусмотрены сведения, углубляющие материал, требующие логического обоснования. Этот уровень позволяет учащимся проявлять способность к дополнительной самостоятельной работе.
Опыт использования дифференциального подхода к контролю знаний учащихся покажу на примерах: разноуровневые контрольные работы по химии в 9 классе. Дифференцированные контрольные работы представлены в нескольких вариантах. Задания работы сгруппированы в три уровня: «А», «В», «С». В уровень «А» включены задания, проверяющие усвоение необходимого минимума конкретных знаний по химии. Выполнение ее требует от учащихся репродуктивной деятельности, оцениваю ее выполнение на «3». При выполнении уровня «В» учащиеся должны уметь раскрыть причинно-следственные связи, применять теоретические знания для объяснения конкретных явлений. Выполнение уровней «А» и «В» оцениваю на «4». Уровень «С» содержит задания, требующие целостного восприятия материала, самостоятельно проводить обобщение и сравнение. Выполнение этого уровня оцениваю на «5».
Источники материалов:
Царева Т.В., Реализация дифференцированного подхода в обучении химии как одно из направлений современных педагогических технологий. https://sarschool76.narod.ru/Tv_pab_ctv.pdf
Зуева М. В., Гара Н. Н. Контрольные и проверочные работы по химии. 8-9 кл.: методическое пособие. М.: Дрофа, 2002.
Иванова Р. Г. Вопросы, упражнения и задания по химии: пособие для учащихся 8-9 кл. М.: Просвещение, 2002.
Радецкий А. М. Проверочные работы по химии в 8-11 классах: пособие для учителя. М.: Просвещение, 2001.
Контрольная работа № 1
Электролитическая диссоциация
1 вариант
Уровень А
1.Какие из перечисленных веществ являются электролитами: сахар, H2, KCl, H3PO4, CuO, Ba(OH)2 , Fe(NO3)3, бензин?
2.Напишите уравнения диссоциации следующих электролитов:
H2SO3 → BaCl2 →
NaOH → Fe2(SO4)3 →
3.Приведите формулы 2-3 веществ, при растворении которых в водном растворе образуются ионы железа Fe3+.
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) HCl + KOH →
Б)* MgCl2 + NaOH →
Уровень С
5.* Допишите уравнение реакции. Составьте ионные уравнения в полной и сокращенной форме:
K2CO3 + … → … + H2O + CO2
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
2H+ + SiO32- =H2SiO3
Контрольная работа № 1
Электролитическая диссоциация
2 вариант
Уровень А
1.Какие из перечисленных веществ являются неэлектролитами: сахар, H2, NaCl, H2SO4, MgO, KOH , Ba(NO3)2, спирт?
2.Напишите уравнения диссоциации следующих электролитов:
HNO3 → ZnCl2 →
Ca(OH)2 → Na3PO4 →
3.Напишите химические формулы электролитов, если известно, как они диссоциируют:
А) ? ↔ Mg2+ + 2NO3 — Б) ? ↔ 2К+ + SO42-
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) KCl + AgNO3 →
Б)* Ba(NO3)2 + Na2SO4 →
Уровень С
5.* Допишите уравнение реакции. Составьте ионные уравнения в полной и сокращенной форме:
Cu(NO3)2 + … → Cu(OH)2 +
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
3Ca2+ + 2PO43- = Ca3(PO4)2
Контрольная работа № 1
Электролитическая диссоциация
3 вариант
Уровень А
1.Какие из перечисленных веществ являются неэлектролитами: сахар, O2, MgCl2, H2SO4, FeO, KOH , Zn(NO3)2, спирт?
2.Напишите уравнения диссоциации следующих электролитов:
KNO3 → AlCl3 →
Ba(OH)2 → Na2SO4 →
3.Напишите химические формулы электролитов, если известно, как они диссоциируют:
А) ? ↔ Fe2+ + 2NO3 — Б) ? ↔ 3Na+ + PO43-
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) NaBr + AgNO3 →
Б)* BaCl2 + CuSO4 →
Уровень С
5.* Допишите уравнения реакций. Составьте ионные уравнения в полной и сокращенной форме:
CuCl2 + … → Cu(OH)2 + …
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
3Zn2+ + 2PO43- = Zn3(PO4)2
Контрольная работа № 1
Электролитическая диссоциация
4 вариант
Уровень А
1.Какие из перечисленных веществ являются электролитами: сахар, N2, BaCl2, HNO3, CO, Ca(OH)2 , FeSO4, бензин?
2.Напишите уравнения диссоциации следующих электролитов:
Na2SO3 → MgCl2 →
KOH → Al2(SO4)3 →
3.Приведите формулы 2-3 веществ, при растворении которых в водном растворе образуются карбонат-ионы СО32-.
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) HNO3 + NaOH →
Б)* ZnCl2 + KOH →
Уровень С
5.* Допишите уравнения реакций. Составьте ионные уравнения в полной и сокращенной форме:
FeCl3 + … → AgCl + …
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
Ba2+ + SiO32- =BaSiO3
Контрольная работа по теме “Неметаллы»
1 вариант
Уровень А
Выберите один правильный ответ.
Какой заряд ядра атома кремния:
+14
+28
+3
+4
Количество валентных электронов углерода:
2
4
6
12
Возможная валентность серы:
II
II, IV
II, IV, VI
II, IV, VI, VIII
Возможная валентность фосфора:
I
III
III, V
I, III, V, VII
Степень окисления углерода:
+2; -2
+4
-4
-4; +4; +2
Может быть красным или белым:
кислород
азот
сера
фосфор
Основной компонент воздуха:
кислород
азот
хлор
углекислый газ
Графит и алмаз состоят из:
фосфора
кремния
углерода
водорода
Формула оксида углерода (II):
CO
H2CO3
CO2
C2H2
Явление аллотропии не свойственно:
сере
азоту
фосфору
углероду
Формула летучего водородного соединения азота:
N2
NH3
NH4
NO
Формула сильного окислителя, который обугливает органические вещества:
H2SO4
H2S
H2SO3
SO3
Ядовитое вещество, светится в темноте, воспламеняется при 40 С:
Пластическая сера
Красный фосфор
Белый фосфор
Озон
Формула оксида кремния IV:
Si
SiO2
H2SiO3
SiO
Какой газ нельзя собрать в сосуд методом вытеснения воды:
водород
кислород
азот
аммиак
Формула соды:
CaCO3
Na2CO3
K2CO3
H2CO3
Уровень В
Допишите правильный ответ
Какое вещество используют в медицине, для приведения человека в чувства ______.
Для получения газированной воды используют _______ газ.
Это газообразное соединение углерода является сильным ядом ________.
Вещества, образующиеся при взаимодействии аммиака с кислотами называются _______.
Самый твердый природный минерал — ______.
Основные отрасли силикатной промышленности – это ________.
Уровень С
Допишите уравнения реакций
S + O2
H2S + Zn
H2SO4 + CuO
HNO3 + NaOH
HCl + K2CO3
H2SO4 + BaCl2
NH3 + HСl
CO2 + CaO
Составьте уравнения реакций по схеме:
H2 → NH3 → (NH4)2SO4 → BaSO4
Запишите уравнение реакции по схеме в молекулярном и ионном виде:
Na2SiO3 → H2SiO3
Контрольная работа по теме “Неметаллы»
2 вариант
Уровень А
Выберите один правильный ответ.
1.Какой заряд ядра атома азота:
+14
+28
+7
+5
Количество валентных электронов серы:
6
4
2
12
Возможная валентность углерода:
II
II, IV
II, IV, VI
II, IV, VI, VIII
Возможная валентность азота:
I
III
III, V
I, II, III, IV, V
Степень окисления фосфора:
+3; +5; -3
+3; +7
-5; +5
+3; +5
Может быть кристаллической или пластической:
кислород
азот
сера
фосфор
Явление аллотропии свойственно:
водороду
азоту
хлору
фосфору
Очень твердый, прозрачный минерал:
алмаз
кремний
графит
фуллерит
Формула оксида углерода (IV):
CO
H2CO3
CO2
C2H2
Явление адсорбции свойственно:
сере
азоту
фосфору
углероду
Формула аммиака:
N2
NH3
NH4
NO
Формула сильного окислителя, который с белками образует вещества желтого цвета:
H2SO4
NH3
HNO3
SO3
Ядовитое вещество с неприятным запахом тухлых яиц:
Пластическая сера
Сернистый газ
Белый фосфор
Сероводород
Формула кремниевой кислоты:
Si
SiO2
H2SiO3
SiO
Какой газ в промышленности получают из азота и водорода:
оксид азота (II)
угарный газ
фосфин
аммиак
Формула известняка, мела:
CaCO3
Na2CO3
K2CO3
H2CO3
Уровень В
Допишите правильный ответ
Какое вещество используют в производстве спичек, для вулканизации каучука ______.
«Сухой лед» — это твердый _______.
В быту нашатырным спиртом называют водный раствор ________.
Распознать кислород и оксид углерода (IV) можно с помощью _______.
Ядовитое, желтоватое вещество с чесночным запахом, светящееся в темноте — ______.
Основное сырье силикатной промышленности – это ________.
Уровень С
Допишите уравнения реакций
P + O2
H2SO4(разб) + Zn
HNO3 + CaO
HNO3 + Na2CO3
H2SO4 + NH3
Na2SiO3 + HCl
NH4Сl
SO3 + MgO
Составьте уравнения реакций по схеме:
CO2 → Na2CO3 → CO2 → CaCO3
Запишите уравнение реакции по схеме в молекулярном и ионном виде:
H2SO4 → BaSO4
Контрольная работа по теме «Металлы»
1 вариант
Уровень А. Выберите один правильный ответ.
| 7. Степень окисления +2 проявляют металлы: а) Mg, Ca, Ba б) Li, Na, Ca в) Al, Fe, Mg
8.Какой из металлов является самым легким? a) натрий б) литий в) алюминий
9. Самый тугоплавкий металл: а) железо б) хром в) вольфрам
10. Электропроводность и теплопроводность металлов объясняется особым строением кристаллической решетки: а) наличием свободных электронов б) наличием ионов металла в узлах решетки в) наличием нейтральных атомов в узлах
11. Практически осуществима следующая реакция: а) MgSO4 + Fe → б) FeCl2 + Cu → в) CuSO4 + Zn →
12. Формула гашеной извести: а) Са(ОН)2 б) СаО в)CaСО3 13. Какой металл называют «крылатым»? а) железо б) алюминий в) кальций
14. При взаимодействии хлорида железа (II) с гидроксидом натрия наблюдается выпадение: а) коричневого осадка б) синего осадка в) белого осадка (на воздухе зеленеет) |
Уровень В. Допишите правильный ответ.
Наличие в природной воде солей кальция и магния обуславливает …… .
Связь, которую осуществляют свободные электроны между ионами металлов, называют ….
Самый распространенный металл в земной коре – это …..
Металлы, находящиеся в I группе главной подгруппе периодической системы называют …..
Сплав железа, содержащий 2-4% углерода, называется ….
Установите соответствие между реагирующими веществами и продуктами их взаимодействия:
| Продукты взаимодействия | |
| А Б В Г | 1) СаO + CO2; 2) СаCO3 + CO2 + H2O; 3) Са3N2; 4) СаSO4 + H2S + H2O; 5) СаSO4 + H2; 6) СаSO4 + H2O. |
Уровень С.
Восстановите левые части уравнений:
… + … = 2NaOH + H2
… + … = 2AlCl3 + 3H2
… + … = MgSO4 + 2H2O
… + … = Cu + ZnSO4
… + … = Ca(OH)2
… + … = Fe(OH)3 + 3KCl
Запишите уравнения реакций по схеме:
L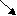 i → Li2O → LiOH → Li2SO4
i → Li2O → LiOH → Li2SO4
LiOH
Контрольная работа по теме «Металлы»
2 вариант
Уровень А. Выберите один правильный ответ.
|
8.Какой из металлов, электронные формулы которых записаны ниже, наиболее химически активен? a) 1s б) 1s в) 1s
9.Восстановительные свойства в ряду элементов: Sr––Ca––Mg––Be а) усиливаются б) ослабевают в) изменяются периодически
10. Схема превращений Fe представляет собой процесс: а) восстановления б) окисления в) не относится к окислительно-восстановительным процессам
11.Какой из гидроксидов проявляет амфотерные свойства? а) Mg(OH) б) Fe(OH) в) Ba(OH)
12.Соли какого металла окрашивают пламя в кирпично-красный цвет: а) Al б) Mg в) Ca
13. Какой ион обусловливает жесткость воды: а) Ba б) Mg в) K 14. Формула негашеной извести: а) СаО б) Ca(ОН)2 в) СаCO
|
Уровень В. Допишите правильный ответ.
Способность металла изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку называется …… .
Металлы располагаются в основном в …. и ….. части периодической таблицы.
Второе место по распространенности среди металлов в земной коре занимает …..
Металлы в химических реакциях являются …..
Сплав железа, содержащий 0,3-2% углерода, называется ….
Установите соответствие между реагирующими веществами и продуктами их взаимодействия:
| Продукты взаимодействия | |
| А Б В Г | 1) Fe2(SO4)3 + SO2 + H2O; 2) FeCl3; 3) FeCl2 + H2; 4) FeSO4 + H2; 5) Fe3O4; 6) Fe3O4 + H2. |
Уровень С.
Восстановите левые части уравнений:
… + … = 2NaCl + H2
… + … = 2AlCl3
… + … = CaSO4 + H2O
… + … = Sn + MgSO4
… + … = AlCl3 + 3H2O
… + … = Fe(OH)2 + 2NaCl
Запишите уравнения реакций по схеме:
С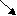 а → СаO → Са(OН)2 → СаСO3
а → СаO → Са(OН)2 → СаСO3
Са(OH)2
