Разработка урока по химии в 9 классе
Валеева Елена Николаевна,
учитель химии высшей квалификационной категории
МБОУ «Гимназия №32»
г. Нижнекамск Республика Татарстан
Тема урока: Неметаллы в периодической системе. Состав воздуха.
Цели урока:
Образовательные:
Обеспечить усвоение учащимися положения неметаллов в Периодической системе химических элементов Д.И.Менделеева, особенностей строения их атомов и физических свойств
Актуализировать знания учащихся на явлении аллотропии, для представления общей характеристики неметаллов
Развивающие:
создать условия для развития умений учащихся анализировать, обобщать, делать выводы, сравнивать.
Воспитательные:
способствовать развитию навыков коммуникативного общения учащихся.
Тип урока: урок усвоения новых знаний.
Методы обучения: словесные (рассказ, объяснение, беседа); иллюстративные (схемы); наглядные (мультимедийное наглядное пособие); проблемно-поисковый.
Ход урока.
І. Организационный момент.
ІІ. Актуализация знаний
С целью актуализации знаний учитель зачитывает цитату из книги Ганты Тибор « Жизнь и ее происхождение».
«Прежде чем приступить к разговору об интересной истории образования Земли, нам необходимо ознакомиться с элементарным составом вселенной. Если бы нам удалось каким – то образом получить усредненный образец материала, из которого построена вселенная, подсчитать и сгруппировать все отдельные атомы, мы с удивлением обнаружили бы, что атомы самого легкого элемента являются самыми распространенными, а также в первенстве ему не уступают еще три химических элемента, которые являются важнейшими компонентами живой материи …»
Вопрос классу: Как вы, думаете, о каких химических элементах идет речь? И определите тему урока.
Итак, тема нашего сегодняшнего урока – «Неметаллы».
III. Изучение нового материала
1.Положение неметаллов в ПСХЭ Д.И.Менделеева.
Неметаллы расположены в основном в правом верхнем углу ПС, условно ограниченном диагональю бор-астат. Самым активным является фтор.
Для атомов неметаллов, по сравнению с атомами металлов характерны:
меньший атомный радиус;
четыре и более электрона на внешнем энергетическом уровне.
Отсюда и такое важнейшее свойство атомов неметаллов – тенденция к приёму недостающих до 8 электронов, т.е. окислительные свойства. Качественной характеристикой атомов неметаллов, т.е. своеобразной мерой их неметалличности, может служить электроотрицательность, т.е. свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары. Электроотрицательность – мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
Изменение свойств атомов неметаллов
Заполните пробелы в утверждениях
В периоде
Радиус атома ……….
Окислительные свойства ……………..
Восстановительные свойства …………………..
Число электронов на внешнем слое …………………….
В группе
Радиус атома ……………….
Окислительные свойства ………………………..
Восстановительные свойства …………………..
Число электронов на внешнем слое ……………………..
Предполагаемые ответы учащихся:
В периоде
Радиус атома уменьшается
Окислительные свойства увеличиваются
Восстановительные свойства уменьшаются
Число электронов на внешнем слое увеличивается
В группе
Радиус атома увеличивается
Окислительные свойства уменьшаются
Восстановительные свойства увеличиваются
Число электронов на внешнем слое не изменяется
2. Кристаллическое строение неметаллов-простых веществ. Аллотропия.
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
газы – H2, O2, O3, N2, F2, Cl2;
жидкость – Br2;
твердые вещества – модификации серы, фосфора, кремния, углерода и др.
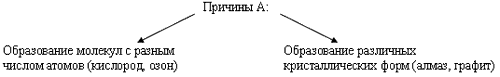
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода. Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
3. Химические свойства неметаллов.
Неметаллы в химических реакциях могут быть восстановителями и окислителями (фтор, кислород.)
Допишите уравнения реакции, укажите какие свойства проявляют неметаллы.
Cl2 + Na
Cl2+ P
Cl2 + NaI
C + CuO
C + HNO3
Предполагаемые ответы учащихся:
Cl2 + 2Na 2NaCl
5Cl2+2 P 2 PCl5
Cl2 + 2NaI I2 + 2NaCl
Хлор в уравнениях реакции является окислителем
C + CuO CO + Cu
C + 2HNO3 2CO2 + NO2 + H2O
Углерод в уравнениях реакции является восстановителем.
Выводы:
Элементы-неметаллы расположены в главных подгруппах III–VIII групп ПС Д.И. Менделеева, занимая её верхний правый угол.
На внешнем электронном слое атомов элементов-неметаллов находятся от 3 до 8 электронов.
Неметаллические свойства элементов усиливаются в периодах и ослабевают в подгруппах с увеличением порядкового номера элемента.
Высшие кислородные соединения неметаллов имеют кислотный характер (кислотные оксиды и гидроксиды).
Атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
Закрепление изученного материала.
Вставьте слова, пропущенные в тексте.
1. Атомы ………. в отличие от атомов металлов легко принимают наружные электроны, являются ……………….
2. Неметаллические свойства элементов с увеличением порядкового номера в периодах …………………….
3. В группах неметаллические свойства элементов …………………..
Определите, окислителем или восстановителем является сера в следующих реакциях:
H2+S=H2S
S — ………………….
2SO2 + O2 → 2SO3
S — ………………………
Предполагаемые ответы учащихся:
1. Атомы неметаллов в отличие от атомов металлов легко принимают наружные электроны, являются окислителями.
2. Неметаллические свойства элементов с увеличением порядкового номера в периодах увеличиваются.
3. В группах неметаллические свойства элементов уменьшаются
Определите, окислителем или восстановителем является сера в следующих реакциях:
H2+S=H2S
S — окислитель
2SO2 + O2 → 2SO3
S — восстановитель
Состав воздуха (работа по учебнику стр.74)
Заполните таблицу
| Содержание газов, % | ||
| По объему | По массе | |
| Азот (N2) |
|
|
| Кислород (O2) |
|
|
| Благородные газы (Ar, He, Ne, Kr) |
|
|
Предполагаемые ответы учащихся:
| Содержание газов, % | ||
| По объему | По массе | |
| Азот (N2) | 78 | 75,5 |
| Кислород (O2) | 21 | 23,2 |
| Благородные газы (Ar, He, Ne, Kr) | 1 | 1,3 |
ПОДВЕДЕНИЕ ИТОГОВ УРОКА.
Д/З
§ 16 в.1 с.75
Почему химически неверно поэтически выражение: « В воздухе пахло грозой»?
.
Список использованной литературы
Габриелян О.С. Химия. 9 класс. М.: Дрофа, 2010.
Игнатьева С.Ю. Химия. Нетрадиционные уроки, Учитель, Волгоград, 2003
