1001 идея интересного занятия с детьми


















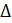

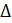
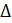

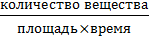 СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ Олейник Валентина Петровна, МБОУ гимназия №23 г. Краснодара , учитель химии.
Предмет (направленность): химия.
Возраст детей: 10 класс.
Место проведения: класс.
Комментарий к цику уроков:«Скорость химических реакций».
Понимание, а не просто заучивание наизусть химии, невозможно без активной мысли учащегося, без сознательного отношения к тому, что должно быть усвоено.
Любая форма проведения эксперимента (демонстрационная, индивидуальная или групповая) всегда проверяется посредством вопросов и заданий, начинающихся словами: почему, объясните, сравните, докажите, определите и т.д. Такие вопросы способствуют более сознательному усвоению материала, так как правильный ответ может быть дан не в виде готовой формулировки, а требует творческого применения накопленных знаний.
В зависимости от профиля класса и количества часов, отведенных на изучение данной темы (2-4часа) материал урока трансформируется, но суть и основные формы, и методы сохраняются.
1 ЗАНЯТИЕ: лекция по теме: «Скорость химических реакций».
Раздел химии, изучающий СХР и влияния на них различных факторов, называется химической кинетикой. Скорость изменяется в широких пределах (взрыв — коррозия). Но многие реакции могут протекать по-разному в зависимости от условий осуществления. Для того чтобы вещества A и B вступили в реакцию, молекулам этих веществ необходимо сблизиться на расстояние соизмеримое с межатомным расстоянием этой молекулы. Только тогда возможны: переход атома от одной молекулы в другую; переход электрона от одной частицы к другой; перераспределение ē, образующих химическую связь, то есть изменения, которые составляют сущность химической реакции.
Молекулы движутся с большими скоростями – в газе сотни м/сек. Находясь «в полете» молекула вступить в реакцию не может. Состояние сближения молекул осуществляется лишь при их столкновении. И естественно чем больше молекул в данном объеме, чем быстрее они будут перемещаться, чем меньше их масса, тем за единицу времени они столкнуться чаще, то есть тем больше скорость движения молекул. Это можно выразить математически: SAB = LNA × NB (S – число соударений в единицу времени, L- коэффициент пропорциональности, NA NB – число молекул вещества A и B).
Переходя от числа столкновений молекул в единице объема, получаем число столкновений молекул A и B пропорциональное концентрации этих веществ. Поэтому скоростью реакции называется: количество изменяющегося в реакции вещества в единице реакционного пространства за единицу времени.
Если вышесказанное выразить в единицах измерения, то:
Гомогенная система: Гетерогенная система:
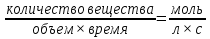
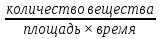 Математически выражается:
Математически выражается:
Vгет = Vгом = 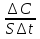


Если С– концентрация исходного вещества, то С 0 и ставится знак (-), если концентрация продуктов реакции, то С 0, следовательно (+).
Основываясь на этих представлениях и применяя выводы молекулярно – кинетической теории строения вещества норвежские химики К. Гульдберг и П. Вааг в 1879 году предложили закон действующих масс (ЗДМ) или основной закон химической кинетики:
Скорость реакции должна быть пропорциональна концентрации реагирующих веществ.
Например кинетические уравнения:
A + B = X V = K CA × CB
A + B + C = X V = K CA × CB × Cc
2A + B = X V = K CA2 × CB; где K – константа скорости, которая зависит от природы реагирующих веществ.
Концентрации находятся в степенях равным стехиометрическим коэффициентам веществ.
Действительна эта запись только для элементарных уравнений.
В действительности механизм реакции очень сложен и протекает в несколько стадий, из которых только одна – самая медленная – определяет скорость реакции.
Например: 2H2 + O2 -› 2H2O
На самом деле процесс образования воды складывается из 6 элементарных актов (реакций) и имеет характер ценной:
H2 + O2 -› 2OH
OH + H2 -› H2O + H
H + O2 -› OH + O
O + H2 -› OH + H
H + O2 -› OH + H
Но если мы будем пользоваться элементарным уравнением СХР, можно измерить по изменению любого из реагентов и продуктов, но численное значение V зависит от этого выбора:
N2 + 3H2 -› 3NH3
Значения СХР рассчитанные на CN2 или CNH2 неодинаковы, но связаны между собой соотношением 1 : 3 : 2.
Факторы, влияющие на скорость реакции.
Природа реагирующих веществ.
Природа – строение атома, степень ионизации, сродство к ē, энергия разрыва связи, строение кристаллической решетки, степень диссоциации электролитов и т.д.
Например (Лабораторный опыт №1):
Fe -› HCl -›
HCl + Zn -› Zn + H2SO4 -›
Mg -› HNO3 -›
Концентрация (площадь соприкосновения) — основной закон кинетики. Например:(Лабораторный опыт №2 сгорание порошка алюминия)
Температура – лабораторный опыт №3.
2Сu+O2=t˚2CuO
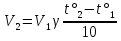
где γ – Температурный коэффициент.
Как это объяснить?
На первый взгляд, кажется, что она связана с увеличением молекулярных столкновений. Однако это не совсем так. Рассчитано, что при повышении t˚ на 100 С число столкновений возрастает на 1,6%, а число прореагировавших молекул на 200% — 400%.
С.Аррениус в 1889 году предположил, что влияние t˚ сводится к увеличению числа активных молекул, то есть молекул, столкновение которых приводит к обращению продуктов реакции (эффект столкновений).
Катализатор – Лабораторный опыт №4.
2H2O2=K2H2O=O2 ; K=MnO2
Вещества, которые изменяют скорость химической реакции, оставаясь в конце неизменными как качественно, так и количественно называют Катализаторами (К).
Чаще ускоряются реакции, но и замедляются (ингибиторы).
Природа каталитического действия:
Действие К связано с понижением EA процесса за счет активного участия К в процессе:
А + В =АВ (К)
А + К = АК АК + В = АВ + К
Например: SO2 + 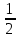 O2 -› SO2
O2 -› SO2
EA = 240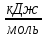 , на поверхности платинового К EA = 60
, на поверхности платинового К EA = 60 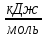 .
.
Виды катализа:
А) гомогенный
Аутокатализ – процесс ускоряется одним из продуктов реакции:
2KMuO4 + 5K2SO3 + 3H2SO4 -› 2MuSO4 + 6K2SO4 + 3H2O
K -› Mu
Б) гетерогенный – образование «активных центров»; где «С» увеличивается.
Селективность К CO + H2
K (Co, Ni ) парафины
K (Fe ) олефины K — катализаторы
CO + H2 K( ZnO × CuO) метанолы
K( ZnO × CrO3) высшие спирты
K(Fe + BeO) альдегиды, кетоны
Промотирование: увеличение активности центров (Fe + Al2O3)
катализатор промотор
Отравление К – уменьшение активности центров под действием «ядов».
В) ферменты, гормоны, витамины – биокатализаторы.
2 ЗАНЯТИЕ: семинар по теме: «Скорость химических реакций».
План семинара.
Теоретическая разминка – повторение.
Химическая кинетика
Математические выражения скорости химических реакций для гомогенных и гетерогенных систем.
Основной закон химической кинетики.( по материалам предыдущего урока. Смотри приложение №2)
Факторы, влияющие на скорость реакции (решение экспериментальных задач)
Природа реагирующих веществ.
Концентрация.
Температура (правило Вант – Гоффа, уравнение Аррениуса).
Катализаторы (природа каталитического действия, виды катализа).
Решение расчетных задач по теме «Скорость химических реакций».
Биология и физика о скорости химических процессов.
Подведение итогов.
Теоретическая разминка.
В чем суть понятия «химическая кинетика»?
Как математически выражается скорость химических реакций для гомогенных и гетерогенных систем?
В чем суть основного закона химической кинетики (ЗДМ).
Как влияют внешние факторы и природа реагирующих веществ на скорость химических реакций?
Значение влияния различных факторов на скорость реакций в природе.
Экспериментально – теоретическая часть:
Эту часть урока организуем по-разному в зависимости от отведенного времени и специализации класса. Экспериментальные задачи могут выполняться индивидуально, в группх и демнстрационно. На каждый опыт отводится определенное время, а затем обсуждаются результаты, делаются выводы и оформляются на доске и в тетрадях. Например, предлагаются опыты:
Лабораторный опыт №1.
«Влияние природы реагирующих веществ на скорость химической реакции».
Zn + 2HCl -› ZnCl2 + H2
Mg + 2HCl -› MgCl2 + H2
Вывод: Отдача ē (окисление) у Mg происходит быстрее, следовательно, ускоряется процесс реакции №2.
+ 2HCl -› ZnCl2 + H2
Zn + H2SO4 -› ZnSO4 + H2
+2CH3COOH ›(CH3COO) 2Zn+H2
Вывод: степень диссоциации кислот разная, следовательно, V — разная и зависит от строения вещества.
Лабораторный опыт №2.
«Влияние температуры на скорость химических реакций».
O O
5 C C + 2KMnO4 + 3H2SO4 —t˚› 10CO2 + 2MnSO4 +K2SO4 + 8H2O
HO OH
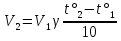
Как это объяснить?
Правило Вант – Гоффа и уравнение:
Что такое энергия активации и в какой зависимости находится она от константы скорости реакции?
Лабораторный опыт №4.
«Влияние катализатора на скорость химической реакции».
Fe(SCN)3 + Na2S2O3
Fe(SNC)3 + Na2S2O3 ( + CuSO4)
2Fe(SCN)3 + 2Na2S2O3 К 2Fe(SCN)2 + Na2S4O6+ 2Na SCN
CuSO4 — катализатор.
Вывод: катализаторы – это вещества, ускоряющие химическую реакцию качественно и количественно оставаясь без изменения. Скорость химической реакции зависит от присутствия катализатора или ингибитора.
Как это объяснить?
1. Природа катализа;
2. Какие вы знаете виды катализа?
Решение расчетных задач по теме «СХР».
(На каждом столе находятся карточки с набором задач. Предлагается индивидуальное, групповое или командное решение).
Написать кинетические уравнения следующих стехиометрических или элементарных уравнений.
Например:
Задание: Решение:
2SO2 + O2 = 2SO3 —› (V = K CSO22 × CО2)
Fe2O3 + CO = 2FeO + CO2 —› (V = K CCO)
N2 + 3H2 = 2NH3 —› (V = K CN2 × CH23)
Как изменится скорость реакции 2NO(г) + O2(г) = 2NO2(г) если уменьшить объем сосуда в 3 раза?
V = K(CNO2 × CO2)
V1 = K(3 × CNO2) × (3 × CO2) = 9 × 3K CNO2 × CO2 = 27
Ответ: в 27 раз.
Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастет реакция при повышении t˚ от 20˚C до 75˚C?
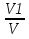 = 2,8;
= 2,8; 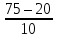 = 5,5; lg
= 5,5; lg 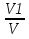 = 5,5; lg 2,8 = 5,5 × 0,447 = 2,458
= 5,5; lg 2,8 = 5,5 × 0,447 = 2,458
Отсюда: 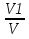 = 287
= 287
Ответ: скорость реакции увеличится в 287 раз.
Смесь SO2 и O2 стехиометрического состава для реакции получения SO3 было выдержано над K при постоянном объеме системы, после чего концентрация SO2 уменьшилась в 25 раз. Во сколько раз изменилась концентрация O2?
Ответ: так как отношение молярных количеств газов соответствует коэффициенту в уравнении реакции, то это отношение не изменяется при протекании реакции, следовательно, CO2 изменится в 25 раз.
Заслушивание фрагментов творческих работ учащихся по темам: «Ферменты – биологические катализаторы», «Витамины», «Гормоны». ( с использованием мультимедийного проектора)
Итоги:
Анализ активности работы учащихся на уроке, выставление оценок.
Домашнее задание: составить по две задачи на использование формул математического выражения скорости реакций; подготовить примеры из курсов биологии и физики по данной теме; повторить материал предыдущего урока-лекции
Голубева Р.М. «Открой для себя мир химии» — М: Экомир, 2002
Егоров А.С., Дионисьев В.Д. и другие «Химия (пособие-репетитор)» Ростов Н/Д: Феникс, 1996
Кузьменко Н.Е., Еремин В.В. «Химия. Теория и примеры решения задач. » — М: 1-я федеративная киноторговая компания, 1998.
Новошинский И.И., Новошинская Н.С. «Химия 10 класс» — М: Оникс 21 век, 2004.
Оганисян Э.Т. «Руководство по химии поступающим в вузы» — М: Высшая школа, 1994.
7
