Районный конкурс учителей биологии и химии «Методическая копилка» Номинация «Предметный словарь педагога» Аринова Нелли Ивановна
Химический словарь
«Химия от А до Я»
Атом – (от греч. atomos — неделимый) — наименьшая частица химического элемента, сохраняющая все его химические свойства. Каждому элементу соответствует определенный вид атомов. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. В целом атом нейтрален. Атомы могут существовать как в свободном состоянии, так и в соединении с атомами того же элемента или других элементов, образуя молекулы.
Бензол – С6Н6 –простейший представитель ароматических углеводородов. Бесцветная жидкость с характерным запахом, т. пл. 5,5° C, т. кип. 80° C. Бензол хорошо растворим в спирте, эфире, хлороформе. Бензол сам хорошо растворяет жиры и масла, смолы, резину, алкалоиды. Бензол получают из каменноугольной смолы, из коксового газа. Бензол горит, устойчив к окислителям (KMnO4). Вступает в реакции замещения с Cl2, HNO3, H2SO4. Бензол применяется в анилинокрасочной промышленности, в производстве фармацевтических препаратов, как сырье для получения синтетического каучука, пластмасс, в производстве взрывчатых веществ, как растворитель. Бензол физиологически весьма активен, пары бензола при высоких концентрациях действуют на центральную нервную систему. Жидкий Бензол сильно раздражает кожу.
Воздух – естественная смесь газов, главным образом азота и кислорода, образующая земную атмосферу. Воздух необходим для нормального существования подавляющего числа наземных живых организмов: кислород, содержащийся в воздухе, в процессе дыхания поступает в клетки организма и используется в процессе окисления, в результате которого происходит выделение необходимой для жизни энергии (метаболизм, аэробы). В промышленности и в быту кислород воздуха используется для сжигания топлива с целью получения тепла и механической энергии в двигателях внутреннего сгорания. Из воздуха методом сжижения получают инертные газы. В соответствии с Федеральным Законом «Об охране атмосферного воздуха» под атмосферным воздухом понимается «жизненно важный компонент окружающей среды, представляющий собой естественную смесь газов атмосферы, находящуюся за пределами жилых, производственных и иных помещений».
Горение – сложный физико-химический процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света (пламя). В большинстве случаев основу горения составляют экзотермические окислительные реакции вещества, способного к горению (горючего), с окислителем, например, горение метана: СН4 + 2О2 = СО2 + 2Н2О
Диссоциация – распад электролитов (кислот, щелочей, солей) на ионы при их растворении в воде или расплавлении; например, диссоциация соляной кислоты HCl ↔ H+ + Cl—. Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Европий – (Europium, от названия Европы) Eu, элемент № 63 III группы 6-го периода периодической системы Д. И. Менделеева, лантанид, атомная масса 152. Металл. В соединениях проявляет валентности II, III. Соли розового или бледно-желтого цвета.
Железо – (Ferrum, от лат. — крепость) Fe , № 26 элемент VIII группы 4-го периода периодической системы Д. И. Менделеева, атомная масса 56. Является одним из наиболее распространенных элементов в природе. Встречается в виде руд и самородного железа. Входит в состав гемоглобина и имеет большое биологическое значение. Серебристо-белый пластичный металл. Легко подвергается ковке, прокатке. В промышленности получают в виде различных сплавов с углеродом — чугунов и углеродистых сталей. В соединениях проявляет главным образом валентность II, III.
Золото – (Aurum, от лат. aurora — утренняя заря) Au элемент №79 I группы 6-го периода периодической системы Д. И. Менделеева, атомная масса 197. Относится к числу рассеянных элементов, в природе встречается в самородном состоянии. Благородный металл желтого цвета, весьма тягучий и ковкий. Нерастворимо ни в щелочах, ни в кислотах, но растворимо в смесях HCl и HNO3 (царская водка), взаимодействует с галогенами. В соединениях проявляет валентность I, III. Золото используют как международный денежный эквивалент. Золото применяется в ювелирном и зубоврачебном деле. Сплавы с платиной используют для изготовления химической аппаратуры, сплавы с платиной и серебром — в электротехнике.
Индикатор – (от лат. indicator — указатель) вещество, изменяющее свою окраску в зависимости от реакции среды. Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции.
Широко используются кислотно-основные индикаторы, разбавленные растворы которых обладают способностью заметно изменять цвет, в зависимости от кислотности раствора. Причина изменения цвета — изменения в строении молекул индикатора в кислой и щелочной среде, что приводит к изменению спектра поглощения раствора. Например, кислотно-щелочные индикаторы:
| В кислой среде | В щелочной среде | |
| Фенолфталеин | бесцветный | малиново – красный |
| Лакмус | красный | синий |
| Метиловый оранжевый | розовый | желтый |
Йод – (Iodum, от греч. iodos — фиолетовый) элемент № 53 VII группы 5-го периода периодической системы Д. И. Менделеева, атомная масса 127. Относится к галогенам. В природе встречается в виде солей натрия, калия, магния; из морской воды концентрируется некоторыми видами водорослей. Открыт в 1811 г. Б. Куртуа. Простое вещество I2 кристаллы черно-серого цвета с фиолетовым металлическим блеском. При обычной температуре испаряется с образованием фиолетовых паров, обладающих резким запахом. Растворим в большинстве органических растворителей. Проявляет в соединениях валентность: I, V, VII. Йод и его соединения используют в медицине, как реактивы в химических лабораториях. В промышленности применяют при получении высокочистых металлов. Недостаток йода в организме приводит к нарушению деятельности щитовидной железы.
Катализатор – вещество, способное изменять скорость химической реакции, само оставаясь при этом неизменным. Катализатор обеспечивает более быстрый путь для реакции: он реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется. Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества. Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь). Для каждого типа реакций эффективны только определённые катализаторы. Наиболее распространенными катализаторами являются: металлы (Pt, Pd, Ni, Co, Fe), оксиды (V2O5, MnO2, Cr2O3, NiO), сульфиды (MoS2, WS2, CoS) и др. вещества.
Латунь – сплав меди с цинком (60—90% Cu и 40—10% Zn). Легирующими компонентами являются Al, Si, Pb, Mn, Sn, Fe и др. Латунь обладает высокими механическими свойствами и хорошо противостоит коррозии в атмосферных условиях. Латунь применяют для изготовления различных металлических деталей, в строительстве морских судов, самолетов, приборов, химической аппаратуры.
Молекула – (от лат. moles — масса) наименьшая частица простого или сложного вещества, обладающая его основными химическими свойствами. Состав и строение молекулы данного вещества не зависит от способа его получения. Число атомов, входящих в молекулу, различно: от двух (например, молекула водорода H2, молекула хлора Cl2, молекула азота N2, молекула оксида углерода (II) СО и др.) до сотен и тысяч — макромолекулы (например, молекулы полиэтилена, белков и др.).
Нейтрон – (от лат. neuter — ни тот, ни другой) электрически нейтральная элементарная (т.е. неразделимая) частица с массой 1,67.10- 27 кг. Нейтроны вместе с протонами входят в состав атомных ядер. Открыт Дж. Чедвиком в 1932 году, за это открытие он получил Нобелевскую премию по физике в 1935 году.
Оксиды – (оксиды, от лат. oxygenium — кислород) сложные вещества, состоящие из атомов двух химических элементов, один из которых — кислород. В зависимости от химических свойств различают солеобразующие оксиды, разделяющиеся на основные (например, Na2O, CuO), кислотные (например, SO3, NO2) и амфотерные (например, ZnO, Al2O3), и несолеобразующие оксиды (например, CO, NO).
Пробирка – специализированный сосуд цилиндрической формы, имеющий полукруглое, коническое или плоское дно. Широко используется в химических лабораториях для проведения некоторых химических реакций в малых объемах, для отбора проб химических веществ. Чаще всего изготавливается из специального лабораторного стекла (пирекс, симакс и др), иногда из кварцевого стекла. Делают пробирки и из пластика (с помощью литья под давлением). Поверхность пробирок иногда обрабатывается антимикробными веществами и веществами, препятствующими «прилипанию» воды к стенкам.
Ртуть – (от лат. Hydrargerum — жидкое серебро) Hg элемент № 80 II группы 6-го периода периодической системы Д. И. Менделеева, атомная масса 201. Известна с древних времен. В природе мало распространена, встречается иногда в самородном состоянии, но чаще в виде минерала сульфида ртути (киновари) HgS. Ртуть при нормальных условиях — блестящий жидкий металл, т. пл. —39° C, заметно испаряется уже при комнатной температуре, пары ртути ядовиты! Ртуть химически малоактивна, растворяется в концентрированных азотной и серной кислотах, а также в царской водке; с серой и галогенами взаимодействует сравнительно легко. В соединениях проявляет валентность I, II. Ртуть растворяет ряд металлов (золото, серебро, цинк, свинец, олово и др.), образуя амальгамы. Применяется во многих приборах (термометры, барометры, реле, высоковакуумные насосы); в виде ртутного катода: в производстве хлора и щелочей, для получения металлов высокой чистоты, для извлечения металлов, как капельный электрод в полярографии; как катализатор в органической химии; в электротехнике — производство ламп дневного света, кварцевых ртутных ламп и т. д.
Смесь – вещество, состоящее из молекул или атомов двух или нескольких веществ (неважно — простых или сложных). Вещества, из которых состоит смесь, могут быть разделены. Примеры: воздух, морская вода, сплав двух металлов, раствор сахара и т.д.
Титрование – способ определения МОЛЯРНОСТИ раствора вещества А с помощью раствора вещества Б, которое реагирует с веществом А. К точно отмеренному объему исследуемого раствора А по каплям добавляют раствор Б известной концентрации. Окончание реакции определяют с помощью ИНДИКАТОРА. По объему израсходованного раствора Б судят о числе молей вещества А в отобранной пробе и во всем растворе А.
Углерод – (Carboneum, от лат. назв. угля) С, № 6, элемент IV группы 2-го периода периодической системы Д. И. Менделеева, атомная масса 12. По решению Международного съезда химиков (1961 г.) 1/12 массы изотопа 12С принята за единицу атомной массы. Углерод существует в виде нескольких аллотропных форм (алмаз, графит). В соединениях углерод проявляет валентность IV, реже II. При обычных условиях химически мало активен, однако при нагревании проявляет высокую реакционную способность. Соединения углерода составляют главную часть всех органических веществ и продуктов их разложения. Химия соединений углерода выделена в отдельную область — органическую химию. Углерод входит в состав многих сплавов (сталь, чугун), его применяют для изготовления электродов, тиглей, в производстве черного пороха, при выплавке металлов из руд (кокс), в качестве адсорбента (активированный уголь), в химической промышленности.
Формула – условное обозначение химического состава и структуры веществ с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п.). Химические формулы являются составной частью языка химии, на их основе составляются схемы и уравнения химических реакций, а также химическая классификация и номенклатура веществ. Химическая формула может обозначать или отражать:
1 молекулу или 1 моль вещества; качественный состав (из каких химических элементов состоит вещество); количественный состав (сколько атомов каждого элемента содержит реальная или условная молекула вещества). Например, формула HNO3 обозначает: азотную кислоту; 1 молекулу азотной кислоты или 1 моль азотной кислоты; качественный состав: молекула азотной кислоты состоит из водорода, азота и кислорода; количественный состав: в состав молекулы азотной кислоты входят один атом элемента водорода, один атом элемента азота, три атома элемента кислорода.
Химия – одна из областей естествознания, наука, изучающая химические элементы и их соединения (состав, свойства, строение), а также взаимные превращения (химические реакции). Современная химия подразделяется на неорганическую, органическую, физическую, аналитическую. Современная химия тесно переплетается с другими науками, в результате чего возникают пограничные области науки: биохимия, геохимия, агрохимия, космохимия и др. Развитие химической науки и техники ведет к интенсивному росту химической промышленности, которая играет важную роль в техническом прогрессе всех отраслей народного хозяйства.
Цирконий – (Zirkonium, от перс. zargun — золотой камень) Zr, элемент № 40, IV группы 5-го периода периодической системы Д. И. Менделеева, атомная масса 91. Открыт в 1789 г. М. Клапротом. Основное сырье — минерал циркон ZrSiO4. Цирконий — серебристо-белый металл, в химически чистом виде исключительно ковок и пластичен. Проявляет валентность IV. В обычных условиях малоактивен. Цирконий и его сплавы являются конструкционным материалом в ядерной энергетике; применяется также цирконий как газопоглотитель в электровакуумной технике, как легирующий элемент в металлургии и т. д.
Чугун – нековкий сплав железа с углеродом (обычно более 2% С). Углерод в чугуне может содержаться в виде цементита и графита. В зависимости от формы графита и количества цементита, выделяют: белый, серый, ковкий и высокопрочные чугуны. Нелигированный чугун содержит примеси Si, Mn, Р и S. Легированный чугун может содержать дополнительно легирующие элементы (Cr, Ni, Mo, Cu, Al, более 2% Mn, более 4% Si). Широко применяется в машиностроении.
Шлам – от нем. Schlamm — грязь) отходы продукта, составляющие пылевые и мелочные его части, получаемые в виде осадка при промывке какого-либо рудного материала. Шлам – продукт, содержащий обычно благородные металлы, отделяющиеся в виде осадка при электролизе меди, цинка и др. металлов.
Щёлочь – растворимое в воде сильное основание. К щелочам относятся гидроксиды металлов главных подгрупп I и II групп таблицы Д. И. Менделеева и гидроксид аммония. Гидроксиды щелочных металлов, как LiOH, NaOH, KOH, являются самыми сильными основаниями и называются едкими щелочами. Гидроксиды щелочноземельных металлов — Ca(OH)2, Sr(OH)2, Ba(OH)2 — более слабые основания. Щелочи — твердые, белые гигроскопические вещества. Все щелочи в растворах распадаются на катионы металлов и гидроксид-ионы ОН-. При их растворении выделяется большое количество теплоты. Растворы щелочей окрашивают лакмус в синий цвет, фенолфталеин — в малиново-красный. Щелочи разъедают ткани, особенно животные. Щелочи широко применяются в различных отраслях промышленности.
Элемент – вид атомов одного вида с одинаковым зарядом ядра. Все элементы имеют изотопы. Взаимосвязь, закономерности в свойствах химических элементов отражает периодическая система элементов Д. И. Менделеева. К 1969 г. открыто в природе и получено искусственно 104 химических элемента. К середине 2012 года известно 118 химических элементов (с порядковыми номерами с 1 по 118), из них 94 обнаружены в природе (некоторые лишь в следовых количествах), остальные 24 получены искусственно в результате ядерных реакций. Предпринимались попытки синтеза следующих сверхтяжёлых трансурановых элементов, в т.ч. были заявления о синтезе элемента унбиквадий (124) и косвенных свидетельствах о элементах унбинилий (120) и унбигексий (126), которые пока не подтверждены. Также было объявлено об обнаружении элемента экатория-унбибия (122) в образцах природного тория. Не все из известных на сегодня 118 элементов имеют утвержденные ИЮПАК постоянные названия. Самым тяжёлым из официально признанных элементов, имеющих официальные постоянные названия, является 116-й, получивший в мае 2012 года имя ливерморий вместе со 114-м элементом флеровием. Названия сверхтяжёлых элементов с номерами 113, 115, 117, 118, полученные в 2002—2010 годах в России и США, официально пока не утверждены. Они имеют временные систематические названия.
Юглон – 5-окси-1,4-нафтохинон, вещество растительного происхождения, обнаружен в кожуре зелёного ореха в виде гликозида, представляет собой мелкие кристаллы жёлто-оранжевого цвета с температурой плавления не ниже 151°С. Юглон невзрывоопасен, хорошо растворим в этиловом спирте, плохо растворим в воде. Юглон хранят в затемнённых банках при температуре не выше 25°С, предохраняя от действия влаги и света. Юглон относится к физиологически активным соединеним. При работе с ним следует соблюдать меры личной гигиены, избегать его распыления. Применяется в медицине для лечения кожного туберкулеза, волчанки и д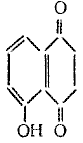 ругих кожных заболеваний, его формула:
ругих кожных заболеваний, его формула:
Ядро – составная часть атома, в которой сосредоточена основная масса его и положительный электрический заряд. Атомное ядро состоит из нуклонов (протонов и нейтронов). Положительный заряд атомного ядра равен числу (Z) входящих в него протонов. Это число совпадает с порядковым номером данного элемента в периодической таблице Д. И. Менделеева. Сумма числа протонов и нейтронов называется массовым числом.
