Областное государственное автономное образовательное учреждение
среднего профессионального образования
«Ангарский техникум общественного питания и торговли»
Утверждаю
Директор ГАПОУ ИО АТОПТ
_____________/С.А. Карп/
«___»______________20___г.
Комплект контрольно-оценочных средств
по учебной дисциплине
ХИМИЯ
основной профессиональной образовательной программы
по специальности
260807 Технология продукции общественного питания
Ангарск, 2014
Комплект контрольно-оценочных средств разработан на основе Федерального государственного образовательного стандарта среднего профессионального образования по специальности 260807 Технология продукции общественного питания, основной профессиональной образовательной программы по данной специальности, рабочей программы учебной дисциплины Химия.
Разработчик(и):
ОГАОУ СПО АТОПТ преподаватель химии, биологии Бочарова Ю.А.
2. Результаты освоения учебной дисциплины, подлежащие проверке 4
3. Распределение оценивания результатов обучения по видам контроля 10
5. Распределение типов и количества контрольных заданий по элементам знаний и умений, контролируемых на промежуточной аттестации. ..………16
6. Контрольные задания ………………………………………………………..18
6.1. Контрольная работа №1………… ……………………………………….18
6.1.1.Пояснительная записка ……………………………………..……………18
6.1.2. Текст задания…………………………………………………………….. 18
6.1.3. Время на подготовку и выполнение …………………………………….23
6.1.4. Перечень контроля и оценивание ..………………………………………23
6.1.5. Пакет проверяющего ……………………………………………………..25
7. Перечень материалов, оборудования и информационных источников, используемых при аттестации………………………………………………….67
8. Лист согласования изменений и дополнений к КОС ………………………69
Пояснительная записка
Контрольно-оценочные средства (КОС) предназначены для контроля и оценки образовательных достижений студентов, освоивших программу учебной дисциплины Химия.
КОС включают контрольные материалы для проведения текущего контроля и промежуточной аттестации в форме дифференцированного зачёта, предусмотренного учебным планом специальности учебного заведения.
КОС разработаны на основании:
— ФГОС по специальности 260807 Технология продукции общественного питания
— основной профессиональной образовательной программы по специальности 260807 Технология продукции общественного питания.
— рабочей программы учебной дисциплины Химия, утвержденной на заседании ЦМК 10.09.2013г
2. Результаты освоения учебной дисциплины, подлежащие проверке
2.1. В результате аттестации по учебной дисциплине осуществляется комплексная проверка следующих умений и знаний, а также динамика формирования общих компетенций:
Таблица 1.1
| Показатели оценки результата
| |
| Уметь: |
|
| У1. называть: изученные вещества по тривиальной или международной номенклатуре;
| — Характеризовать свойства органических веществ, дисперсных и коллоидных систем — Распознавать свойства органических веществ — Различать по химическим формулам, видам связи, функциональной группам, классы органических веществ — соотносить формулу вещества и класс углеводородов — выбирать название углеводорода
|
| У2. определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических и органических соединений, окислитель и восстановитель, принадлежность веществ к разным классам неорганических и органических соединений; | — Заканчивать уравнения химических реакций, согласно степени окисления элементов — Расставлять коэффициенты в уравнениях химических реакциях согласно закону сохранения массы — Перечислять отличия органических веществ друг от друга по химическим свойствам — Определять степень окисления элементов — выбирать свойства, изменяющееся в периоде или группе — выбирать сумму коэффициентов в полном ионном уравнении реакции — выбирать изомер к данному веществу — выбирать кислоты, основания, соли, оксиды из предложенных формул — По строению вещества определять его общую формулу, название, типы реакций, продукты реакций. |
| У3. характеризовать: элементы малых периодов по их положению в Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных неорганических и органических соединений; | — выбирать кислоты, основания, оксиды, соли — выбирать элементы побочных подгрупп — называть и выбирать максимальное количество электронов на орбиталях — выбирать число протонов нейтронов и электронов у атомов элементов — выбирать степень окисления элемента — определять и выбирать количество элементов в группе, периоде — выбирать относительную молекулярную масса вещества — находить относительную молекулярную масса вещества |
| У4. объяснять: зависимость свойств веществ от их состава и строения, природу химической связи (ионной ковалентной, металлической и водородной), зависимость скорости химической реакции и положение химического равновесия от различных факторов; | — Составлять уравнения химических реакций согласно изменениями, происходящими с продуктами в ходе технологического процесса — Определять, согласно принципу ЛеШателье, изменение химического равновесия в обратимых реакциях под действием различных факторов. — Называть условия, от которых зависит равновесие в обратимых реакциях — Перечислять условия необратимости реакций — Называть признаки, от которых зависит скорость химических реакций — соотносить формулу и вид химической связи в ней |
| У5. выполнять химический эксперимент: по распознаванию важнейших неорганических и органических соединений;
| — Подбирать реактивы и оборудование для проведения химических реакций согласно условиям протекания и групповым реагентам. — Манипулировать химическим оборудованием, соблюдая правила техники безопасности — Называть основные правила техники безопасности при работе в химической лаборатории; — Выполнять действия в соответствии с правилами — Называть виды лабораторного оборудования — Называть вещества с которыми реагируют кислоты, щелочи, основания, оксиды, соли, органические вещества — Называть виды лабораторного оборудования (воронок, колб, пипеток, стаканов) — Перечислять правила использования лабораторного оборудования — выбирать вещества, с которыми взаимодействует данное — называть вещества, с которыми взаимодействует данное
|
| У6. проводить: самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах; | — выбирать суждения, согласно тексту — находить в тексте доказательства к проблеме, ответы на вопросы — перечислять свойства материалов и веществ — на основе текста называть главную мысль — На основе текста выбирать истинные и ложные суждения. — Устанавливать логическую последовательность данных, составлять схемы — Анализируя явления выбирать истинные и ложные, исправлять ошибки |
| У7. связывать: изученный материал со своей профессиональной деятельностью;
| — Записывать уравнения химических реакций по схеме — Различать тип химической реакции по её записи химической — Указывать признаки классификации и типы химических реакций — осуществлять схему превращений одних веществ в другие |
| У8. решать: расчетные задачи по химическим формулам и уравнениям;
| — Вычислять искомую величину по массе, объему, количеству вещества — Составлять пропорции для нахождения искомых величин по уравнению реакции — Анализировать содержание и условия задач — Определять искомые величины по заданным согласно законам химии — Сопоставлять искомые величины и выбирать формулы для их нахождения — Производить вычисления, используя формулы искомых величин и данные по условию — Подбирать формулы для вычисления искомых величин — Записывать условия задачи химическими символами для выполнения расчетов массы и количества вещества — выбирать максимальную валентность атома — решать задачи на количество вещества, растворы молекулярную формулу вещества — Выбирать нужный способ получения веществ с заданными свойствами. |
| У9. использовать приобретенные знания и умения в практической деятельности и повседневной жизни:
| — Перечислять лабораторное оборудование, согласно методам химического анализа — соотносить продукты и виды дисперсных систем — называть типы дисперсных систем — давать определение понятиям дисперсная среда, дисперсная фаза — по процентному отношению определять безопасность данного вещества для экологии — по условиям реакции определять возможность протекания химических реакций — рассчитывать количество воды и вещества для приготовления раствора заданной концентрации — перечислять свойства материалов и веществ -называть виды инфекционных заболеваний — называть вредное воздействие никотина, алкоголя, наркотиков -перечислять меры профилактики при инфекционных заболеваниях -описывать свойства данного вещества |
| З1. важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем газообразных веществ, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология; | -давать определение понятиям: вещество, химический элемент, атом, молекула, окислитель и восстановитель, окисление и восстановление, изомерия, гомология; — Различать понятия окислитель и восстановитель, окисление и восстановление — определять степень окисления — Подбирать свойства групповых реагентов согласно условиям протекания — Давать определения понятиям: изомерия, изомеры, гомологи, функциональная группа, радикал, алканы, алкены, алкины, — выбирать электронное строение атома — выбирать уравнение в котором происходит смещение химического равновесия — объяснять как проходит смещение химического равновесия |
| З2. основные законы химии: сохранения массы веществ, постоянства состава веществ, Периодический закон Д.И. Менделеева;
| -н азывать основные законы химии: закон сохранения массы, закон Авогадро, закон постоянства состава, закон объемных отношений — Давать определение понятиям гидролиз, диссоциация — Химическими символами записывать процесс гидролиза, диссоциации солей различной природы, диссоциации электролитов в водных растворах — Называть химические формулы веществ, растворы которых являются сильными и слабыми электролитами — записывать изомеры и гомологи веществ — выбирать ряд в котором убывают или усиливаются металлические свойства — выбирать самый активный или неактивный металл |
|
З3. основные теории химии; химической связи, электролитической диссоциации, строения органических и неорганических соединений;
|
— Давать определение экзотермические и эндотермические реакции — Различать экзотермические и эндотермические реакции — Записывать уравнения химических реакций, соответствующих химическим свойствам органических веществ — выбрать уравнения реакции, которому соответствует сокращенное — выбирать коэффициенты, стоящие перед формулами в уравнении реакции — выбирать сумму коэффициентов в полном ионном уравнении |
| З4. важнейшие вещества и материалы: важнейшие металлы и сплавы; серная, соляная, азотная и уксусная кислоты; благородные газы, водород, кислород, галогены, щелочные металлы; основные, кислотные и амфотерные оксиды и гидроксиды, щелочи, углекислый и угарный газы, сернистый газ, аммиак, вода, природный газ, метан, этан, этилен, ацетилен, хлорид натрия, карбонат и гидрокарбонат натрия, карбонат и фосфат кальция, бензол, метанол и этанол, сложные эфиры, жиры, мыла, моносахариды (глюкоза), дисахариды (сахароза), полисахариды (крахмал и целлюлоза), анилин, аминокислоты, белки, искусственные и синтетические волокна, каучуки, пластмассы; | — Называть общие формулы, типы гибридизаций, типы реакций, особенности названий классов органических веществ — По химическим формулам определять принадлежность вещества к соответствующему классу органических веществ — Указывать существенные черты понятий: раствор, растворитель, растворенное вещество, золь, гель, студень, аэрозоль, коагуляция, седиментация, синерезис — Описывать свойства растворов и коллоидных систем — Приводить примеры пищевых продуктов, согласно классификации дисперсных и коллоидных систем — соотносить классы углеводородов и формулы веществ |
3. Распределение оценивания результатов обучения по видам контроля
| Виды аттестации | ||
| Текущий контроль | Промежуточная аттестация | |
| У1. называть: изученные вещества по тривиальной или международной номенклатуре; | Практическая работа Тестовые задания Проверочные задания | Дифференцированный зачет ( задания в тестовой форме) |
| У2. определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических и органических соединений, окислитель и восстановитель, принадлежность веществ к разным классам неорганических и органических соединений; | Задания в тестовой форме Работа с учебником, раздаточным материалом | |
| У3. характеризовать: элементы малых периодов по их положению в Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных неорганических и органических соединений; | Сообщения студентов Задания в тестовой форме | |
| У4. объяснять: зависимость свойств веществ от их состава и строения, природу химической связи (ионной ковалентной, металлической и водородной), зависимость скорости химической реакции и положение химического равновесия от различных факторов; | Практическая работа Блиц опрос Проверочные задания Задания в тестовой форме | |
| У5. выполнять химический эксперимент: по распознаванию важнейших неорганических и органических соединений; | Практическая работа | |
| У6. проводить: самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах; | Практическая работа Работа с учебником, раздаточным материалом | |
| У7. связывать: изученный материал со своей профессиональной деятельностью; | Практическая работа | |
| У8. решать: расчетные задачи по химическим формулам и уравнениям;
У9. использовать приобретенные знания и умения в практической деятельности и повседневной жизни:
| Практическая работа Проверочные задания Задания в тестовой форме | |
| З1. важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем газообразных веществ, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология; | Задания в тестовой форме Работа с учебником Блиц опрос Работа с учебником, раздаточным материалом | |
| З2. основные законы химии: сохранения массы веществ, постоянства состава веществ, Периодический закон Д.И. Менделеева; | Задания в тестовой форме | |
| З3. основные теории химии; химической связи, электролитической диссоциации, строения органических и неорганических соединений; | Работа с учебником Работа раздаточным материалом | |
| З4. важнейшие вещества и материалы: важнейшие металлы и сплавы; серная, соляная, азотная и уксусная кислоты; благородные газы, водород, кислород, галогены, щелочные металлы; основные, кислотные и амфотерные оксиды и гидроксиды, щелочи, углекислый и угарный газы, сернистый газ, аммиак, вода, природный газ, метан, этан, этилен, ацетилен, хлорид натрия, карбонат и гидрокарбонат натрия, карбонат и фосфат кальция, бензол, метанол и этанол, сложные эфиры, жиры, мыла, моносахариды (глюкоза), дисахариды (сахароза), полисахариды (крахмал и целлюлоза), анилин, аминокислоты, белки, искусственные и синтетические волокна, каучуки, пластмассы; | Задания в тестовой форме Проверочные задания
|
4. Распределение типов контрольных заданий по элементам знаний и умений текущего контроля.
Условные обозначения к Таблице 4:
УО – устный ответ; ПР– практическая или лабораторная работа; КР – контрольная работа; Т – тестирование; ПК – проверка конспектов; Р – реферат; Д – доклад, презентация; К– курсовая работа, курсовое проектирование; Р – решение задач, Таб — таблица
Таблица 4
| Тип контрольного задания | |||||||||||||
| У1 | У2 | У3 | У4 | У5 | У6 | У7 | У8 | У9 | З1 | З2 | З3 | З4 | |
| Раздел 1. Общая и неорганическая химия | |||||||||||||
| Тема 1.1. Химические свойства и превращения веществ | ПК | Р | | | ПР | УО | ПК | ПК | | ПК | | | ПК УО |
| Тема1.2. Строение вещества | Р |
Р
| ЛР | ПР | ЛР | | | Р | ЛР | ПК | | Р | ПК |
| Тема 1.3. Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома | ПР | Р Т | ПР Т | ПР | | | | Таб | Р | | ПК | | Таб |
| Тема 1.4. Вода. Растворы. Электролитическая диссоциация | Р | | | | ЛР | Д | | Р | ЛР | ПК | | ПК Р УО | |
| Тема 1.5. Классификация неорганических соединений и их свойства | ПР | ПК | ПР Т | УО | ПР | Т | | ПР | | ПК | | Р УО | Р ПК УО |
| Тема 1.6. Химические реакции | ПР | Т | ПР | УО | ЛР | ЛР | | ПР | ЛР | | | Р ПК | |
| Тема 1.7. Металлы и неметаллы | Р | | | УО | | Д Т | Т | | | ПК | ПК | Т | Т |
| Тема 2.1. Основные понятия органической химии и теория строения органических соединений | Р ПР | | Р ПК | УО | | Т | Таб | ПК | | | | Р ПК УО | ПК РУО Т |
| Тема 2.2. Углеводороды и их природные источники | Р | Р | Р | Р УО | | Таб | | | | | | ПР | Р |
| Тема 2.3 Кислородсодержащие органические соединения | | Р | ПР | | ЛР
ПР | С | ЛР | | ЛР | | | ПК | Т Таб |
| Тема 2.4. Азотсодержащие органические соединения. Полимеры | | ПК | | УО | | С | | | | | | ПК | Таб |
5. 1. Распределение типов и количество контрольных заданий по элементам знаний и умений, контролируемых на промежуточной аттестации
Условные обозначения в Таблице 5:
КР1 – Контрольная работа №1
А3 – часть А, вопрос №3
В2 – часть В вопрос №2
С1 – часть С вопрос №1
Таблица №5
| Тип контрольного задания | ||||||||||||||
| У1 | У2 | У3 | У4 | У5 | У6 | У7 | У8 | У9 | З1 | З2 | З3 | З4 | ||
| Раздел 1. Общая и неорганическая химия | ||||||||||||||
| Тема 1.1. Химические свойства и превращения веществ | | КР А13 | | | | | | КР А7 | | КР А9 | | | | |
| Тема1.2. Строение вещества | |
| | КР В1 | | | | | КР В2 | | | | | |
| Тема 1.3. Периодический закон и Периодическая система химических элементов Д.И. Менделеева и строение атома | | | КР А4 КР А8 КР А10 КР А11 КР А12 КР А14 | | | | | | | | КР А5 КР А6 | | | |
| Тема 1.4. Вода. Растворы. Электролитическая диссоциация | КР В3 | | | | | | | КР С1 | | | | КР А2 КР А3 КР А16 | | |
| Тема 1.5. Классификация неорганических соединений и их свойства | | КР А22 | КР А1 | | КР А19 | КР А23 | | | | | | | КР А24 | |
| Тема 1.6. Химические реакции | | КР А15 | | | | | | | | КР А18 | | | | |
| Тема 1.7. Металлы и неметаллы | | | | | | | | | | | | | | |
| Тема 2.1. Основные понятия органической химии и теория строения органических соединений | КР А21 | | | | | | | | | | КР С2 | | | |
| Тема 2.2. Углеводороды и их природные источники | | КР А17 | | | | | КР С3 | | | | | | КР В4 | |
| Тема 2.3 Кислородсодержащие органические соединения | | | | | | | КР А20 | | | | | | | |
| Тема 2.4. Азотсодержащие органические соединения. Полимеры | | | | | | | | | | | | | | |
6. Контрольные задания
Промежуточная аттестация по учебной дисциплине Химия предполагает проведение контрольной работы, которая проводится по итогам изучения дисциплины в конце года на 1 курсе.
6.1. Контрольная работа №1
6.1.1. Пояснительная записка
Контрольная работа направлена на проверку знаний и умений студентов по учебной дисциплине Химия по темам, изучаемым в первом полугодии. Контрольная работа призвана установить уровень усвоения студентами программы дисциплины «Химия», согласно программе Федерального государственного образовательного стандарта основного и среднего (полного) общего образования по химии. В ходе проведения оцениваются основные знания и умения по дисциплине (см. таблицу 5).
Контрольно-оценочные средства разработаны в форме тестовых заданий и содержат 4 варианта. Каждый вариант включает в себя упорядоченный набор заданий. Структура данной контрольной работы представлена тремя частями (А, В и С). Часть А содержит 23 задания репродуктивного уровня и заключается в выборе правильного ответа или ответов из четырех предложенных. Часть В содержит 4 задания на установление последовательности, соответствия. В часть С включено 3 задания творческого уровня, в котором студентам предлагается изомеры и гомологи, осуществить цепочку превращений и решать задачу. Каждое задание позволяет одновременно проверить усвоение теоретического материала по соответствующим темам и оценить умения.
6.1.2. Текст задания.
Общие положения
На выполнение контрольной работы отводится 65 минут. Работа состоит из трех частей. Часть А содержит 23 задания репродуктивного уровня и заключается в выборе правильного ответа или ответов из четырех предложенных. Часть В содержит 4 задания на установление последовательности, соответствия. В часть С включено 3 задания творческого уровня, в котором студентам предлагается изомеры и гомологи, осуществить цепочку превращений и решать задачу. Задачу оформлять в порядке общих требований.
Рекомендуется выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. Если после выполнения всей работы у вас останется время, Вы можете вернуться к пропущенным заданиям.
При выполнении заданий Вы можете пользоваться черновиком. Обращаем Ваше внимание на то, что записи в черновике не будут учитываться при оценивании работы. Количество баллов варьируется в зависимости от сложности задания: в части А – 1 балл, часть В 2 – 3 балла, часть С – 3 — 4 балла. Баллы, полученные Вами при выполнении задания, суммируются.
Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов. Желаем успеха!
Вариант 1
1. Одноосновная бескислородная кислота
А) H2S Б) H2CO3 В) HF Г) HNO3
2. Сумма коэффициентов в полном ионном уравнении BaCl2 + H2SO4=
А) 11 Б) 10 В) 7 Г) 9
3. Коэффициенты перед AlCL3 и NH4Cl в уравнении реакции NH4NO3 + AlCL3 = Al(NO3)3 + NH4Cl соответственно равны…
А) 1 и 2 Б) 1 и 3 В) 3 и 1 Г) 2 и 1
4. Элементы только побочных подгрупп находятся в ряду
А) Sc, Mo, W Б) Ta, Ca, Mn В) As, Br, Cr Г) Sb, Co, Ge
5. Металлические свойства убывают в ряду
А) Ge, Sn, Pb Б) Sr, Y, Mo В) Tc, Nb, Sr Г) K, Rb, Cs
6. Самый активный неметалл
А) At Б) F В) B Г) Si
7. Максимальная валентность атома Se равна
А) 2 Б) 4 В) 8 Г) 6
8. Относительная молекулярная масса K2S
А) 71 Б) 110 ат. ед. м. В) 110 Г) 71 ат. ед. м.
9. Электронное строение атома калия соответствует выражению
А) 1S22S22P63S23P64S1 Б) 1S22S22P63S23P63d1
В) 1S22S22P63S23P7 Г) 1S22S22P63S23P64S2
10. Количество элементов в 5 периоде
А) 18 Б) 32 В) 8 Г) 24
11. Максимальное число электронов на р-орбиталях:
А) 2; Б) 6; В) 10; Г) 14.
12. Число нейтронов в атоме цинка равно:
А) 65; Б) 22; В) 30; Г) 35.
13. В периоде слева направо уменьшается
А) число уровней Б) число валентных электронов
В) радиус атома Г) активность неметаллов
14. Степень окисления атома углерода в соединении Ca(ClO2)2 равна
А ) -4 Б) -3 В) +4 Г) +3
15. Сумма коэффициентов в полном ионном уравнении реакции взаимодействия хлорида кальция и нитрата серебра
А) 10 Б) 8 В) 14 Г) 12
16. Сокращённое ионное уравнение: Fe2+ + 2OH— = Fe (OH)2 соответствует взаимодействию
А) FeCO3 + 2NaOH В) Fe(NO3)2 + 2NaOH С) FeSiO3 + LiOH
D) FeCl2 + Cu(OH)2 Е) FeS+ 2KOH
17. Изомером бутина-1 является вещество:
A) СН2=СН — С2Н5
Б) СН3 – СН – СН3
׀
СН3
В) НС ≡С – С2Н5
Г) Н2С = СН – СН2 – СН3
18. При повышении давления химическое равновесие сместится в сторону исходных веществ в системе…
А)2SO2 + O2![]() 2SO3 +Q
2SO3 +Q
Б) CH4 + H2O ![]() CO + 3H2 — Q
CO + 3H2 — Q
В) CO + 2H2![]() CH3OH + Q
CH3OH + Q
Г) 4HCl + O2![]() 2H2O + Cl2 + Q
2H2O + Cl2 + Q
19. «Бесцветная жидкость с резким запахом, легче воды, хорошо растворим в воде, гигроскопичен, обладает бактерицидными свойствами» — данные свойства соответствуют:
А) бензол Б) этиловый спирт В) сахароза Г) бензол
20. Название вещества
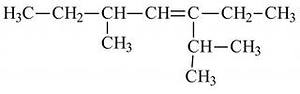
а) 3 метал 5 пропил гептан б) 3 пропил 5 метил гептен3
в) 3 пропил 5 метил гептан г) 2, 5 диметил 3этил гептен 3
21. (Выбрать несколько вариантов ответа)С какими веществами взаимодействует HNO3
а) HCL б) Mg в) P2O5 г) Fe2O3
22. (Выбрать несколько вариантов ответа)Выбрать кислоты:
А) MgCl2 Б) Al(OH)3 В) H3PO4 Г) HF Д) NaOH Е) CO2
23. (Выбрать несколько вариантов ответа)Прочитать текст.
Для изготовления активированного угля используют различные углеродсодержащие материалы органического происхождения: торф, каменноугольный кокс, древесный и коксовый угли. В результате получают вещество, обладающее высокими адсорбирующими и каталитическими свойствами. Именно большое количество пор обуславливает мощную впитывающую способность активированного угля, который используют для поглощения токсических веществ, газообразных соединений. Однако при этом уголь слабо поглощает такие соединения, как щелочи и кислоты. Использование активированного угля эффективно впервые 12 часов после отравления. При отравлении, в том числе тяжелом, активированный уголь нужно принимать еще до промывания желудка. Принимать уголь нужно в расчете 1 таблетка на 10 кг веса. Попадая в организм уголь, подобно губке, впитывает в себя вредные вещества и спустя некоторое время естественным путем выводится вместе с ними.
Выбрать истинные суждения, согласно тексту.(Ответов несколько)
А) Активированный уголь делают из древесного угля
Б) Лучше всего уголь использовать после промывания желудка
В) Активированный уголь эффективен при любых отравлениях
Г) Для подростка весом 60кг нужно выпить 3 таблетки угля
Д) Для подростка весом 60кг нужно выпить 6 таблеток угля
Е) Активированный уголь является адсорбентом
Ж) Эффективнее использовать порошок угля чем таблетки
Часть В
1. Соотнести виды химической связи и формулу вещества
1) ковалентная полярная
2) ионная
А) NaCl Б) HCl В) Mg(OH)2 Г) Cl2 Д) NO2
Ответ оформите в виде таблицы:
| 2 | |
|
|
|
2. Соотнести название продукта и тип дисперсной системы:
1) суспензия
2) порошок
3) гель
А) мука Б) компот В) цукаты Г) холодец
Ответ оформите в виде таблицы:
| 2 | 3 | |
|
|
|
|
3.Соотнести формулы веществ и класс углеводородов. Ответ представить в виде таблицы.
Формулы Класс углеводородов
А) С4Н10 1) Алканы
Б) С6Н12 2) Алкены
В) С2Н6 3) Алкины
Г) С4Н8
Д) С8Н16
Е) С5Н8
4. Соотнести формулу вещества и название класса углеводородов:
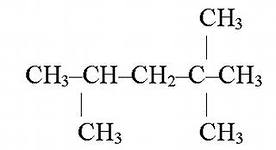
1) ![]() А) предельные углеводороды
А) предельные углеводороды
2) 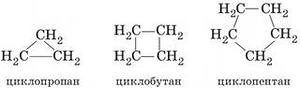 Б) циклопарафины
Б) циклопарафины
3) 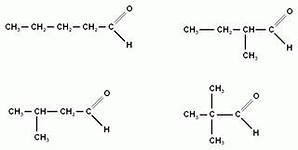 В) альдегиды
В) альдегиды
4)  Г) ацетиленовые углеводороды
Г) ацетиленовые углеводороды
Часть С
21. В 15%-ном раствор кислоты массой 300 г добавили 30г. Рассчитайте массовую долю серной кислоты в полученном растворе.
30.Записать два изомера и два гомолога для 2- метил пентана
31.Осуществить схему превращений:
CH3 ─ CH3 → CH2 ═CH2 → CH ≡CH
Вариант 2
1. Двухосновная бескислородная кислота
А) HNO3 Б) H2SO4 В) H2S Г) HCl
2. Сумма коэффициентов в полном ионном уравнении CuSO4 + NaOH=
А) 9 Б) 8 В) 10 Г) 12
3. Коэффициенты перед Na2SO4 и NaCl в уравнении реакции Na2SO4 + KCL = K2SO4 + NaCl соответственно равны…
А) 2 и 1 Б) 2 и 2 В) 1 и 2 Г) 1 и 1
4. Элементы только главных подгрупп находятся в ряду
А) P, Te, W Б) Sn, K, Al В) Ca, Sc, Ga Г) Ag, Cu, Na
5. Неметаллические свойства увеличиваются в ряду
А) As, Sb, Br Б) Sn, Sb, I В) Ti, Sc, Ca Г) Cu, Ag, Au
6. Самый активный металл
А) K Б) Ca В) Fe Г) Ba
7. Массовая доля магния в MgI2
А) 18,5 % Б) 15,8 % В) 50 % Г) 63%
8. Максимальная валентность атома Ga равна
А) 5 Б) 2 В) 1 Г) 3
9. Относительная молекулярная масса Na2O
А) 62 ат. ед. м. Б) 39 ат. ед. м. В) 62 Г) 39
10. Электронное строение атома серы соответствует выражению
А) 1S22S22P63S23P5 Б) 1S22S22P63S23P6
В) 1S22S22P63S23P4 Г) 1S22S22P63S13P5
11. Количество элементов в 6 периоде
А) 18 Б) 32 В) 24 Г) 8
12. Максимальное число электронов на четвертом энергетическом уровне:
А) 14; Б) 32; В) 26; Г) 18.
13. Число нейтронов в атоме марганца равно:
А) 25; Б) 29; В) 30; Г) 55.
14. В группе сверху вниз уменьшается
А) высшая степень окисления Б) число валентных электронов
В) радиус атома Г) активность неметаллов
15. Степень окисления атома углерода в соединении C2H5NH2 равна
А) -2 Б) — 4 В) +1 Г) +4
16. Сокращённое ионное уравнение: Cu2+ + 2OH— = Cu(OH)2 соответствует взаимодействию
А) CuCO3 + 2NaOH Б) CuSiO3 + LiOH
В) CuCl2 + Fe(OH)2 Г) Cu(NO3)2 + 2NaOH
17. Изомером бутена-2 является вещество:
A) CH3 — CН2 – CH2 – CH3 В) СН3 – СН2 – СН = СН2
Б) СН3 – СН – СН3 Г) СН3 – СН – СН = СН2
׀ ׀
СН3 СН3
18. Изменение давления практически не влияет на смещение химического равновесия в системе..
А) N2 + 3H2![]() 2NH3
2NH3
Б) 2H2 + O2![]() 2H2O
2H2O
В) H2 + Cl2![]() 2HCl
2HCl
Г) SO2 + Cl2![]() SO2Cl2
SO2Cl2
19 . «Бесцветный газ, легче воздуха, не имеет запаха, входит в состав природного газа» — данные свойства соответствуют:
А) этилен Б) нефть В) глицерин Г) бензол
20. Название вещества
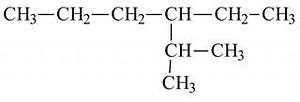
а) 3метил гексан б) 4 пропил гексан
в) 3 пропил гексан г) 2 метил 3 этил гексан
21. (Выбрать несколько вариантов ответа) С какими веществами взаимодействует Na2O
а) KOH б) HNO3 в) KCl г) H2O
22. (Выбрать несколько вариантов ответа) Выбрать соли.
А) Ba(NO3)2 Б) AL2O3 В) P2O5 Г) AL(OH)3
Д) MgCL2 Е) Fe(OH)3
23. (Выбрать несколько вариантов ответа) Прочитать текст.
Вода с большим содержанием солей называется жёсткой. Различают временную жёсткость, обусловленную гидрокарбонатами кальция и магния Са(НСО3)2;Mg(НСО3)2, и постоянную жёсткость, вызванную присутствием других солей. Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. Устранить жесткость можно кипячением воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи. Смягчение при помощи щелочей, замерзанием. Самый простой способ – воспользоваться пищевой содой из расчета четверть чайной ложки на стакан воды. Также для этих целей применяется нашатырный спирт, бура или поташ. Так вот, кальций, содержащийся в жесткой воде в избытке, соединяется с этими выделениями и закупоривает поры. Причем связь тут прямая: чем жестче вода, тем опасней закупорка. При этом под кожей образуются кристаллы кальция – та самая накипь, которая появляется в чайниках. В жесткой воде не мылится мыло, что увеличивает его расход. Кроме того, жесткость воды влияет на качество стирки и продолжительность работы бытовых приборов, в которых используется вода.
Выбрать истинные суждения, согласно тексту.(Ответов несколько)
А) Недостаток кальция, в организме человека лучше восполнять жесткой водой богатой кальцием
Б) Жесткая вода имеет много солей кальция и магния
В) Устранить жесткость воды можно кипячением
Г) Постоянная жёсткость, вызвана присутствием солей магния и кальция.
Д) Уксусная кислота смягчает жесткую воду.
Е) Пить жесткую воду не рекомендуется.
Часть В
1. Соотнести виды химической связи и формулу вещества
1) ковалентная полярная
2) ковалентная неполярная
А) N2 Б) NH3 В) Na2O Г) H2 Д) H2O
Ответ оформите в виде таблицы:
| 2 | |
|
|
|
2. Соотнести название продукта и тип дисперсной системы:
1) эмульсия
2) гель
3) золь
А) сливки Б) творог В) зефир Г) крахмал
Ответ оформите в виде таблицы:
| 2 | 3 | |
|
|
|
|
3.Соотнести формулы веществ и класс углеводородов. Ответ представить в виде таблицы.
Формулы Класс углеводородов
А) С2Н4 1) Предельные
Б) С8Н18 2) Этиленовые
В) С3Н4 3) Ацетиленовые
Г) С2Н2
Д) С6Н14
Е) С7Н14
4. Соотнести формулу вещества и название класса углеводородов
1) 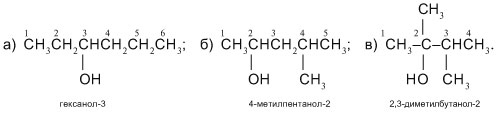 А) предельные углеводороды
А) предельные углеводороды
2)  Б) ароматические углеводороды
Б) ароматические углеводороды
3)  В) альдегиды
В) альдегиды
4)  Г) спирты
Г) спирты
Часть С
1. Какую массу оксида хрома (VI) следует добавить к 275 г 10%-го раствора хромовой кислоты, чтобы увеличить ее массовую долю в два раза?
2.Записать два изомера и два гомолога для гептана.
3.Осуществить схему превращений:
С → CH4 → CH3CL
Вариант 3
1. Двухосновная кислородсодержащая кислота
А) H2S Б) H3PO4 В) H2CO3 Г) HF
2. Сумма коэффициентов в полном ионном уравнении Ba(NO3)2 + H2SO4=
А) 11 Б) 10 В) 12 Г) 9
3. Коэффициенты перед Na2SO4 и NaCl в уравнении реакции Na2SO4 + BaCL2 = BaSO4 + NaCl соответственно равны…
А) 1 и 2 Б) 2 и 1 В) 2 и 2 Г) 1 и 1
4. Элементы только побочных подгрупп находятся в ряду
А) Sc, Ti, As Б) Zr, Na, In В) Co, Ag, Au Г) Fe, Os, I
5. Металлические свойства увеличиваются в ряду
А) Ra, Ba, Ca Б) K, Cs, Fr В) Sc, Ti, V Г) Bi, Sb, As
6. Менее активный неметалл
А) O Б) At В) S Г) Cl
7. Массовая доля кислорода в Ca(OH)2
А) 27 % Б) 68,2 % В) 70 % Г) 54%
8. Максимальная валентность атома Br равна
А) 3 Б) 5 В) 4 Г) 7
9. Относительная молекулярная масса BaCl2
А) 172,5 Б) 172,5 ат. ед. м. В) 208 Г) 208 ат. ед. м.
10. Электронное строение атома скандия соответствует выражению
А) 1S22S22P63S23P64S3 Б) 1S22S22P63S23P64S24P1
В) 1S22S22P63S23P7 4S23d1 Г) 1S22S22P63S23P64S24P2
11. Количество элементов в побочной подгруппе 8 группы
А) 11 Б) 6 В) 10 Г) 5
12. Максимальное число электронов на d — орбиталях:
А) 14; Б) 10; В) 6; Г) 2.
13. Число нейтронов в атоме ниобия равно:
А) 42 Б) 41 В) 52 Г) 24
14. В периоде слева направо уменьшается
А) число уровней Б) число валентных электронов
В) радиус атома Г) активность неметаллов
15. Степень окисления атома углерода в соединении Вa(NO3)2 равна
А) +3 Б) -3 В) +5 Г) -5
16. Сокращённое ионное уравнение: 2H++CO32- =H2O+CO2 соответствует взаимодействию
А) CaCO3 + 2HCl Б) Na2CO3 + H2SiO3 В) CaCO3 + H2SiO3
Г) Na2CO3 + 2HCl Д) BaCO3 + 2HCl
17. Изомером пентадиена-2,3 является вещество:
А) СН2 = СН – СН2 – СН2 – СН3
Б) СН3
׀
СН3 – СН – СН = СН2
В) СН3 – С = СН2
׀
СН – СН3
Г) СН2 = СН – СН2 – СН=СН2
18. При увеличении общего давления равновесие сместится в сторону продуктов в реакции…
А) H2 + Br2![]() HBr
HBr
Б ) 2NH3![]() N2 + 3H2
N2 + 3H2
В) C2H6![]() C2H4 + H2
C2H4 + H2
Г) 2SO2 + O2![]() 2SO3
2SO3
19. «Твердое волокнистое вещество, входящее в состав растений, образуя в них оболочки клеток, вещество не растворимое в воде и в обычных органических растворителях является сырьем для производства ацетатного волокна» — данные свойства соответствуют:
А) полиэтилен Б) каучук В) целлюлоза Г) бензол
20 . Название вещества
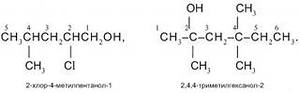
а) 2,4 диметил гексанол 2,4 б) 3,5 диметил гексанол 3,5
в) 2 метил гексанол 2,5 г) 2, 4, 4 три метил гексанол 2
21. (Выбрать несколько вариантов ответа) С какими веществами взаимодействует NaOH
а) Al2O3 б) H2SO4 в) H2O г) CuCl2
22. (Выбрать несколько вариантов ответа) Выбрать оксиды.
А) Al(OH)3 Б) SO2 В) MgCl2 Г) K2SiO3
Д) Fe2O3 Е) CaSO4
23. (Выбрать несколько вариантов ответа) Прочитать текст.
Основная причина выпадения кислотных дождей — наличие в атмосфере за счет промышленных выбросов оксидов серы и азота, хлористого водорода и других кислотообразующих соединений. Эти частицы вступают в реакцию с водой атмосферы, превращая ее в растворы кислот, которые и понижают рН дождевой воды. В результате дождь и снег оказываются подкисленными. Присутствие в воздухе заметных количеств, аммиака или ионов кальция приводит к выпадению не кислых, а щелочных осадков. Вода обычного дождя тоже представляет собой слабокислый раствор. Это происходит вследствие того, что природные вещества атмосферы, такие как двуокись углерода (СО2), вступают в реакцию с дождевой водой. При этом образуется слабая угольная кислота (CO2 + H2O —> H2CO3). В идеале рН дождевой воды равняется 5.6-5.7. Значение рН измеряется на шкале от 0 до 14. В воде и водных растворах присутствуют как ионы водорода(Н+), так и гидроксид-ионы (ОН-). Когда концентрация ионов водорода (Н+) в воде или растворе равна концентрации гидроксид-ионов (ОН-) в том же растворе, то такой раствор является нейтральным. Значение рН нейтрального раствора равняются 7. Водяные растения лучше всего растут в воде со значениями рН между 7 и 9.2.Кислотные дожди являются одной из причин гибели жизни в водоемах, лесов, урожаев, и растительности. Кроме того кислотные дожди разрушают здания и памятники культуры, трубопроводы, приводят в негодность автомобили, понижают плодородие почв и могут приводить к просачиванию токсичных металлов в водоносные слои почвы.
Выбрать истинные суждения, согласно тексту.(Ответов несколько)
А) Термином «кислотные дожди» называют все виды метеорологических осадков: дождь, снег, град, туман, дождь со снегом, — рН которых меньше, чем среднее значение рН дождевой воды
Б) «Обычный» дождь имеет рН нейтральную.
В) Аммиак и его соединения нейтрализуют кислотные дожди в атмосфере.
Г) При увеличении концентрации ионов Н+ раствор становится менее кислым.
Д) Кислотные дожди оказывают влияние на здоровье человека.
Е) «Обычный» дождь имеет рН слабокислую.
Ж) При увеличении концентрации ионов ОН—раствор становится более кислым.
Часть В
1. Соотнести виды химической связи и формулу вещества
1) ионная
2) ковалентная неполярная
А) NaF Б) BaCl2 В) Al2 Г) HBr Д) HCl
Ответ оформите в виде таблицы:
| 2 | |
|
|
|
2. Соотнести название продукта и тип дисперсной системы:
1) суспензия
2) эмульсия
3) гель
А) молоко Б) мармелад В) мед Г) газированная вода
Ответ оформите в виде таблицы:
| 2 | 3 | |
|
|
|
|
3.Соотнести формулы веществ и класс углеводородов. Ответ представить в виде таблицы.
Формулы Класс углеводородов
А) С4Н8 1) Алкены
Б) С5Н8 2) Алканы
В) С6Н12 3) Алкины
Г) С4Н6
Д) С7Н16
Е) С8Н16
4. Соотнести формулу вещества и название класса углеводородов:
1)  А) карбоновые кислоты
А) карбоновые кислоты
2)  Б) диеновые углеводороды
Б) диеновые углеводороды
3)  В) альдегиды
В) альдегиды
4) 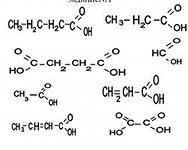 Г) ароматические углеводороды
Г) ароматические углеводороды
Часть С.
1. Какую массу оксида селена (VI) следует добавить к 100 г 15%-го раствора селеновой кислоты, чтобы увеличить ее массовую долю вдвое.
2.Записать два изомера и два гомолога для 2,2 диметил пентана.
3.Осуществить схему превращений:
CH2CL─CH2CL → CH2═CH2 → CH3─CH2OH
Вариант 4
1. Одноосновная кислородсодержащая кислота
А) H3PO4 Б) HBr В) HNO2 Г)H2SiO3
2. Сумма коэффициентов в полном ионном уравнении NaNO3 + Fe(OH)3=
А) 13 Б) 12 В) 15 Г) 17
3. Коэффициенты перед NaI и Na2SO4 в уравнении реакции NaI + MgSO4 = MgI2 + Na2SO4 соответственно равны…
А) 1 и 2 Б) 2 и 1 В) 2 и 2 Г) 1 и 1
4. Элементы только главных подгрупп находятся в ряду
А) Se, Br, Co Б) Ga, Ge, Zr В) Ba, Rb, Cu Г) Ra, Sr, Be
5. Неметаллические свойства уменьшаются в ряду
А) Ca, Sr, Ba Б) Cl, S, Si В) Cl, Br, I Г) B, N, F
6. Менее активный металл
А) Na Б) Rb В) Mg Г) Ti
7. Массовая доля кислорода в H2CO3
А) 54% Б) 25,8 % В) 60 % Г) 77,4%
8. Максимальная валентность атома Rb равна
А) 6 Б) 3 В) 5 Г) 1
9. Относительная молекулярная масса AlCl3
А) 98 Б) 98 ат. ед. м. В) 133,5 Г) 133,5 ат. ед. м.
10. Электронное строение атома кремния соответствует выражению
А) 1S22S22P63S23P2 Б) 1S22S22P63S23P6
В) 1S22S22P63S13P3 Г) 1S22S22P63S13P5
11. Количество элементов в главной подгруппе 6 группы
А) 7 Б) 4 В) 5 Г) 6
12. Максимальное число электронов на третьем энергетическом уровне:
А) 14; Б) 6; В) 10; Г) 18.
13. Число нейтронов в атоме железа равно:
А) 56 Б) 30 В) 26; Г) 36
14. В группе сверху вниз увеличивается
А) число уровней Б) число валентных электронов
В) высшая степень окисления Г) активность неметаллов
15. Степень окисления атома углерода в соединении KMnO4 равна
А) +5 Б) + 7 В) -7 Г) +3
16. Кратное ионное уравнение к данной реакции Al(NO3)3 + 3KOH=AL(OH)3 +3KNO3
A)Cu2++2OH—=Cu(OH)2 Б)H++OH—=HOH В)Al3++3OH—=Al(OH)3
Г)Cu2++S2-=CuS Д)Fe2++2OH—=Fe(OH)2
17. Изомером пентена-2 является вещество:
A) CH3 — CН2 – CH2 – CH2 – CH3 В) СН3 – CH2 –СН2 – СН = СН2
Б) СН3 – СН – CH2 – СН3 Г) СН3 – СН – CH2 – СН = СН2
׀ ׀
СН3 СН3
18. При уменьшении общего давления равновесие сместится в сторону продуктов в реакции…
А) Н2 + I2 ![]() 2НI
2НI
Б) C2H6 ![]() C2H4 + H2
C2H4 + H2
В) FeS ![]() Fe + S
Fe + S
Г) 2SO2 + O2 ![]() 2SO3
2SO3
19. «Твердое вещество, важнейшее свойство его -эластичность, а также устойчивость к истиранию, водо и газонепроницаемость» — данные свойства соответствуют:
А) полиэтилен Б) каучук В) целлюлоза Г) Бензол
20. Название вещества
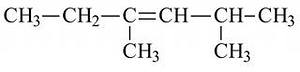
а) 2 метил 4 этил пентен3 б) 3, 5 диметил гексен 3
в) 2 этил 4 метил пентен 2 г) 2, 4 диметил гексен 3
21. (Выбрать несколько вариантов ответа) С какими веществами взаимодействует Ва(OH)2
а) Al2O3 б) H2SO4 в) H2O г) CuCl2
22. (Выбрать несколько вариантов ответа) Выбрать основания.
А) AlCl3 Б) Mg(OН)2 В) SO3 Г) Cu(NO3)2
Д) Fe(OH)3 Е) KF
23. (Выбрать несколько вариантов ответа) Прочитать текст.
Озон — это соединение кислородных атомов. Если в молекуле обычного кислорода два атома, то в молекуле озона их целых три. Озоновый слой располагается в стратосфере на высоте приблизительно 25 километров от земной поверхности. Он очень важен, поскольку защищает Землю от наиболее активных космических лучей, которые без него могли бы убить все живое на планете. Они образуются в местах, где истончается озоновый слой Земли. Имея большую массу, молекулы озона опускаются к поверхности Земли и разрушаются, так как неустойчивы при нормальном давлении. Будучи химически активными, молекулы озона могут реагировать со многими неорганическими и органическими соединениями. Главными веществами, вносящими вклад в разрушение молекул озона, являются простые вещества (водород, атомы кислорода, хлора, брома), неорганические (хлороводород, монооксид азота) и органические соединения (метан, фторхлор- и фторбром фреоны, которые выделяют атомы хлора и брома).
Выбрать истинные суждения, согласно тексту. (Ответов несколько)
А) Озон – это аллотропное изменение атомов кислорода.
Б) У поверхности земли молекулы озона практически не встречаются.
В) Основные вещества, утончающие озоновый слой – это промышленных выбросы оксидов серы и азота.
Г) Озоновый слой входит в состав атмосферы.
Д) От озоновых дыр могут пострадать только люди.
Е) Ослабление озонового слоя усиливает поток солнечной радиации на Землю.
Часть В
1. Соотнести виды химической связи и формулу вещества
1) ковалентная полярная
2) ковалентная неполярная
А) O2 Б) NaNO3 В) H3N Г) H2S Д) Cl2
Ответ оформите в виде таблицы:
| 2 | |
|
|
|
2. Соотнести название продукта и тип дисперсной системы:
1) пена
2) суспензия
3) эмульсия
А) майонез Б) джем В) соль Г) взбитые сливки
Ответ оформите в виде таблицы:
| 2 | 3 | |
|
|
|
|
3.Соотнести формулы веществ и класс углеводородов. Ответ представить в виде таблицы.
Формулы Класс углеводородов
А) С2Н4 1) Предельные
Б) С9Н16 2) Ацетиленовые
В) С11Н22 3) Этиленовые
Г) С5Н8
Д) С8Н18
Е) С3Н8
4. Соотнести формулу вещества и название класса углеводородов:
1)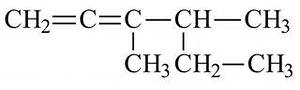 А) ароматические углеводороды
А) ароматические углеводороды
2) 
Б) предельные углеводороды
3) ![]() В) ацетиленовые углеводороды
В) ацетиленовые углеводороды
4)  Г) диеновые углеводороды
Г) диеновые углеводороды
Часть С
1. Рассчитайте массовую долю кислоты в растворе, полученном смешением 200 мл 15%-ного раствора серной кислоты и 150 мл 10%-ного раствора.
2.Записать два изомера и два гомолога для 2-метил гексана.
3. Осуществить схему превращений:
СН3─СН3 → СН3─СН2СL → CH2═CH2
6. 1. 3. Время на подготовку и выполнение
| Время | |
| Подготовка | 5мин |
| Выполнение | 60мин |
| Оформление и сдача | 5мин |
| ВСЕГО | 70мин |
6.1. 4. Перечень контроля и оценки
6.1.5. Пакет проверяющего
Условия проведения.
На выполнение контрольной работы отводится 40 минут. Работа состоит из трех частей. Часть А содержит 7 заданий, в которых надо выбрать правильный ответ или ответы из четырех предложенных (подробнее смотри инструкцию к каждому вопросу). За каждый правильный ответ – 1 балл. Часть В содержит задание на установление последовательности, оформив ответ в виде таблицы. В часть С включено задания творческого уровня, в котором предлагается записать значение произведение растворимости и решить задачу. Задачу оформлять в порядке общих требований.
Ответы
Часть А
| 1 | 2 | 3 | 4 | |
| №1 | в | в | в | в |
| №2 | а | в | а | г |
| №3 | б | в | а | б |
| №4 | а | б | в | г |
| №5 | б | б | б | б |
| №6 | б | г | б | а |
| №7 | г | г | г | г |
| №8 | в | в | в | в |
| №9 | а | в | в | а |
| №10 | а | б | а | г |
| №11 | б | б | б | г |
| №12 | г | в | г | б |
| №13 | в | г | в | г |
| №14 | г | а | в | б |
| №15 | г | г | б | а |
| №16 | в | г | г | в |
| №17 | в | в | г | в |
| №18 | б | в | г | б |
| №19 | б | а | в | б |
| №20 | г | г | г | г |
| №21 | бг | бг | бг | бг |
| №22 | вг | ад | бд | бд |
| №23 | адеж | бвде | авге | абге |
Части ВиС
Вариант 1
1
| 2 | |
| бд | ав |
2.
| 2 | 3 | |
| б | а | г |
3.
| 2 | 3 | |
| ав | бгд | е |
4.
| 2 | 3 | 4 | |
| г | б | в | а |
Вариант 2
1
| 2 | |
| бд | аг |
2.
| 2 | 3 | |
| а | в | б |
3.
| 2 | 3 | |
| бд | ае | вг |
4.
| 2 | 3 | 4 | |
| г | в | г | б |
Вариант 3
1
| 2 | |
| аб | гд |
2.
| 2 | 3 | |
| в | аг | б |
3.
| 2 | 3 | |
| ве | д | бг |
4.
| 2 | 3 | 4 | |
| б | г | в | а |
Вариант 4
1
| 2 | |
| вг | ад |
2.
| 2 | 3 | |
| г | б | а |
3.
| 2 | 3 | |
| де | бг | ав |
В4
| 2 | 3 | 4 | |
| г | б | в | а |
Вариант 1
С1
| Баллы | |
| Ответ правильный и полный, включает все существенные моменты Дано: mр-ра=300г m в-ва=30г ω1 = 15% ω2 = ? 1) m в-ва = 2) m в-ва2 = 45 + 30 = 75г 3) mр-ра2 = 300+ 75= 375г 4) ω2 = 75/375∙100 = 20% | 4 |
| Ответ правильный и полный, включает все названные выше элементы | 3 |
| В ответе допущена одна ошибка | 2 |
| В ответе допущены две серьезные ошибки | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
С2
| Баллы | |
| Ответ правильный и полный, включает два изомера и два гомолога изомеры имеют состав С6Н14 Гомологи различаются от С6Н14 на одну или несколько групп СН2 | 4 |
| В ответе записаны по одному гомологу или изомеру либо два изомера либо два гомолога | 3 |
| В ответе записаны изомеры и гомологи, но допущены две ошибки в написании изомеров или гомологов | 2 |
| В ответе записаны изомеры и гомологи с с тремя – четырьмя ошибками, но хотя бы один изомер или гомолог записан верно | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
С3
| Баллы | |
| Ответ правильный и полный, включает все уравнения реакций — Н2 — Н2 2) CH2 ═CH2 ⟶ CH ≡CH | 4 |
| В ответе записаны уравнения реакций с одной ошибкой | 3 |
| В ответе записаны уравнения с двумя ошибками | 2 |
| В ответе записано только начало или конец уравнений реакций | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
Вариант 2
С1
| Баллы | |
| Ответ правильный и полный, включает все существенные моменты Дано: mр-ра=275г ω1 = 10% ω2 = 10 ∙2 =20% 1) m в-ва = 2) 27,5 г 1 раствора —— 10% Х г раствора ——- 20% Х = 3) m в-ва добавлена = 55 + 27,5 = 27,5г
| 4 |
| Ответ правильный и полный, включает все названные выше элементы | 3 |
| В ответе допущена одна ошибка | 2 |
| В ответе допущены две серьезные ошибки | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
С2
| Баллы | |
| Ответ правильный и полный, включает два изомера и два гомолога изомеры имеют состав С7Н16 Гомологи различаются от С7Н16на одну или несколько групп СН2 | 4 |
| В ответе записаны по одному гомологу или изомеру либо два изомера либо два гомолога | 3 |
| В ответе записаны изомеры и гомологи, но допущены две ошибки в написании изомеров или гомологов | 2 |
| В ответе записаны изомеры и гомологи с с тремя – четырьмя ошибками, но хотя бы один изомер или гомолог записан верно | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
С3
| Баллы | |
| Ответ правильный и полный, включает все уравнения реакций С → CH4 → CH3CL 1) С + 2Н2→ CH4 2) CH4+ Cl2 →CH3CL + HCl | 4 |
| В ответе записаны уравнения реакций с одной ошибкой | 3 |
| В ответе записаны уравнения с двумя ошибками | 2 |
| В ответе записано только начало или конец уравнений реакций | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
Вариант 3
С1
| Баллы | |
| Ответ правильный и полный, включает все существенные моменты Дано: mр-ра=100г ω1 = 15% ω2 = 30% 1) m в-ва = 2) 15г вещества———-15% Х г вещества ———30% Х= 3) mр-ра2 = 30 — 15= 15г | 4 |
| Ответ правильный и полный, включает все названные выше элементы | 3 |
| В ответе допущена одна ошибка | 2 |
| В ответе допущены две серьезные ошибки | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
С2
| Баллы | |
| Ответ правильный и полный, включает два изомера и два гомолога изомеры имеют состав С7Н16 Гомологи различаются от С7Н16 на одну или несколько групп СН2 | 4 |
| В ответе записаны по одному гомологу или изомеру либо два изомера либо два гомолога | 3 |
| В ответе записаны изомеры и гомологи, но допущены две ошибки в написании изомеров или гомологов | 2 |
| В ответе записаны изомеры и гомологи с с тремя – четырьмя ошибками, но хотя бы один изомер или гомолог записан верно | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
С3.
| Баллы | |
| Ответ правильный и полный, включает все уравнения реакций CH2CL─CH2CL → CH2═CH2 → CH3─CH2OH 1) CH2CL─CH2CL + Zn⟶CH2═CH2+ZnCL2 2) CH2═CH2+ НОН ⟶CH3─CH2OH | 4 |
| В ответе записаны уравнения реакций с одной ошибкой | 3 |
| В ответе записаны уравнения с двумя ошибками | 2 |
| В ответе записано только начало или конец уравнений реакций | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
Вариант 4
С1
| Баллы | |
| Ответ правильный и полный, включает все существенные моменты Дано: mр-ра=200г m р-ра=30г ω1 = 15% ω2 = 10% 1) m в-ва = 2) m в-ва2 = 3) mр-ра3 = 200+ 150= 350г 4) mв-ва3 = 30г + 15г = 45г 4) ω2 = 45/350∙100 = 12,8% | 4 |
| Ответ правильный и полный, включает все названные выше элементы | 3 |
| В ответе допущена одна ошибка | 2 |
| В ответе допущены две серьезные ошибки | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
С2
| Баллы | |
| Ответ правильный и полный, включает два изомера и два гомолога изомеры имеют состав С7Н16 Гомологи различаются от С7Н16 на одну или несколько групп СН2 | 4 |
| В ответе записаны по одному гомологу или изомеру либо два изомера либо два гомолога | 3 |
| В ответе записаны изомеры и гомологи, но допущены две ошибки в написании изомеров или гомологов | 2 |
| В ответе записаны изомеры и гомологи с с тремя – четырьмя ошибками, но хотя бы один изомер или гомолог записан верно | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
С3.
| Баллы | |
| Ответ правильный и полный, включает все уравнения реакций СН3─СН3 → СН3─СН2СL → CH2═CH2 1) СН3─СН3+ CL2⟶СН3─СН2СL + HCl 2) СН3─СН2СL + К⟶ CH2═CH2+ КCl | 4 |
| В ответе записаны уравнения реакций с одной ошибкой | 3 |
| В ответе записаны уравнения с двумя ошибками | 2 |
| В ответе записано только начало или конец уравнений реакций | 1 |
| Все элементы записаны неверно, либо нет ответа |
|
Шкала оценивания и перевода баллов в оценки.
| Количество баллов | Оценка | |
| 90 – 100% | 40 – 43 балла | «5» |
| 80 — 89% | 34 – 39 балла | «4» |
| 70 – 79% | 29 – 33 балла | «3» |
| Менее 69% | Менее 29 баллов | «2» |
7. Перечень материалов, оборудования и информационных источников, используемых при аттестации.
7.1.1.Оборудование учебного кабинета:
рабочее место преподавателя;
рабочие места по количеству студентов;
нормативно — правовые акты.
7.1.2 ТСО Технические средства обучения:
компьютер и мультимедийный проектор
Компьютерные программы и другие средства освоения дисциплины:
программа: «Excel»
7.1.3. Информационное обеспечение
Основные источники:
О.С.Габриелян, И.Г. Остроумов Химия М.: Академия, 2005.
Ю.М. Ерохин Химия М.: Академия, 2005.
М.М. Петров Неорганическая химия М.: Химия, 1989.
Л.А. Цветков Органическая химия 10 М.: Владос, 2005.
Дополнительные источники:
Ахметов Н.С. Общая и неорганическая химия: Учеб. 2-е изд., перераб. и доп. М.: Высш. шк., 1988. 639 с.
Решение расчетных задач по химии в средних ПТУ. Т.С. Ярославцева М.: Высшая школа, 1985.
Занимательная химия И.Леенсон М.:Росмэн, 2000.
Книга для чтения по органической химии / В.В.Баулина, М.: Просвещение, 1975.
Г.П. Хомченко, И.Г. Хомченко Сборник задач по химии для поступающих в вузы. М.: Новая волна, 1997.
Я.Л.Гольдфарб, Ю.В. Ходаков Сборник задач и упражнений по химии. М.: Просвещение,1971.
А.А. Журин Сборник упражнений и заданий по химии. М.: Аквариум, 1997.
Задачи и упражнения по химии для средней школы. М.: Просвещение, 1964.
Б.Н.Баженов Сборник задач и упражнений по органической химии Иркутск. 1998.
Г.А. Абкин Задачи и упражнения по общей химии М. Высшая школа, 1998.
Е.Ф. Симонов Сборник задач и упражнений по химии для средних ПТУ
А.Е. Баскаева Сборник задач и упражнений по органической химии М.: Высшая школа, 1976.
Лист согласования
Дополнения и изменения к комплекту КОС на учебный год
Дополнения и изменения к комплекту КОС на __________ учебный год по учебной дисциплине _________________________________________________________________
В комплект КОС внесены следующие изменения:
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Дополнения и изменения в комплекте КОС обсуждены на заседании ЦМК _______________________________________________________
«_____» ____________ 20_____г. (протокол № _______ ).
Председатель ЦМК ________________ /________________
1
