Казенное общеобразовательное учреждение
«Вечерняя (сменная) общеобразовательная школа 1»
г. Омска.
Конспект урока по химии
в 9 классе
«Серная кислота».
Разработала учитель химии
Климова Татьяна Владимировна.
г. Омск
2012г.
Серная кислота.
— Вы пробовали серный ангидрид
Разбавить родниковою водою?
Что проще? SO3 + H2O.
Пишу в кровати, лежа на боку.
Вот – кислота, и больше ничего,
Но, нет! Ведь там, в конце еще +Q!
И не боюсь я больше ничего,
Нет для меня загадок в этом мире.
Я к SO3 прибавил H2O,
И получил — H2SO4.

Открытый урок по химии в 9 классе
по теме «Серная кислота».
Цели урока:
Дидактическая: 1) Повторить понятие «кислоты»
2) Познакомить учащихся с особенностями серной кислоты.
3) Продолжить формирование умения составлять уравнения реакций, характеризующих химические свойства кислот.
Развивающая: 1) Развивать умение обобщать, выделять главное, делать самостоятельные выводы.
2) Развивать умение обращаться с лабораторным оборудованием.
Воспитательная: Продолжить воспитание умения слушать товарища.
Тип урока: Проблемный.
Оборудование и реактивы: 1) Штатив с пробирками, держатель, хим. стакан, стеклянная палочка, спиртовка, деревянная лучинка, кусочки бумаги.
2) H2SO4 (конц.), H2SO4 (разб.) , Zn, CuO, NaOH(р-р), BaCl2(р-р), сахарная пудра, фенолфталеин, универсальная индикаторная бумага.
Тех. Обеспечение: компьютер, мультимедиа.
Ход урока.
1. Организационный этап.
2. Целеполагание.
Цель сегодняшнего урока – повторить состав кислот и познакомиться со свойствами одного из важнейших кислородсодержащих соединений серы – серной кислотой.
В конце урока вы должны будете знать:
1) Состав серной кислоты
2) Ее действие на органические вещества.
3) Правила безопасного обращения с серной кислотой.
4) Черты сходства с другими кислотами.
5) Качественную реакцию.
6) Области применения серной кислоты.
Уметь: 1) Подтверждать все свойства серной кислоты соответствующими уравнениями реакций.
2) Проводить качественную реакцию на практике.
3) Применять полученные знания в жизни.
3. Мотивация.
Знание свойств серной кислоты необходимо не только химикам, но и простым смертным. Вот тому только один пример. На одной из железнодорожных станций в 80-е годы произошла авария, при которой на рельсы из поврежденных цистерн вылилась серная кислота. За двое суток руководство станции так и не решило проблемы нейтрализации кислоты, которая за это время «съела» рельсы, не считая экономического ущерба, который был нанесен остановкой движения. А ведь рядом со станцией работали 2 карьера: песчаный и меловой. Вы к концу урока должны будете решить эту проблему.
4. Актуализация опорных знаний. (Проводится фронтально).
Какие соединения серы вы знаете?
Запишите на доске формулу оксида серы (VI).
Какой это оксид? (основной или кислотный).
Запишите уравнение реакции: SO3 + H2O = ?
Как называется полученное вещество?
5. Основной этап.
1. Химическая (молекулярная) формула серной кислоты: H2SO4
2. Строение молекулы. (демонстрация на мультимедиа)
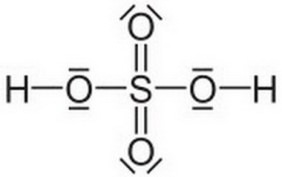
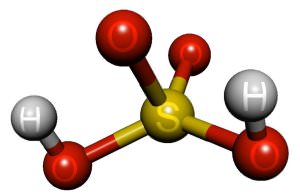
3. Физические свойства.
Учащимся предлагается рассмотреть концентрированную серную кислоту и описать ее физические свойства. После обсуждения учащиеся записывают в тетрадь физические свойства самостоятельно.
H2SO4 — бесцветная, тяжелая, нелетучая жидкость, хорошо растворимая в воде.
При растворении ее в воде происходит очень сильное разогревание. (Демонстрация: растворение конц. H2SO4 в воде).
Вывод: Приливать кислоту в воду!
4. Действие конц. H2SO4 на органические вещества.
1) Демонстрация обугливания лучинки.
Опыт: В пробирку с конц. серной кислотой опустить лучинку. Она почернеет, обуглится.
2) Демонстрация растворения кусочков бумаги, ткани.
Опыт: Погрузить в конц. H2SO4 кусочки бумаги, ткани. Они постепенно разрушаются и растворяются.
3) Демонстрация действия конц. H2SO4 на сахарную пудру.
Опыт: Насыпать в стакан на 100 мл. 15г сахарной пудры. Прилить 15 мл. конц. H2SO4 и сразу же перемешать стеклянной палочкой, так, чтобы образовалась кашица густоты сметаны. Сахар при действии H2SO4 постепенно чернеет. Затем начинается энергичная реакция между образующимся углём и H2SO4.
2 H2SO4 + С = 2Н2О +2SO2 + СО2
Образующиеся газы вспучивают обугленную массу, она поднимается и вылезает из стакана.
(Опыт проходит быстрее и эффективнее, если предварительно смочить сахар водой – температура поднимается выше).
4) Техника безопасности при обращении с серной кислотой.
При попадании на кожу – немедленно смыть большим количеством холодной воды.
4. Черты сходства разбавленной H2SO4 с другими кислотами.
1) Взаимодействие с металлами
H2SO4 + Zn = H2 + ZnSO4 (р. замещения)
2) Взаимодействие с оксидами металлов
H2SO4 + CuO = CuSO4 + H2O (р. обмена)
3) Взаимодействие с основаниями
H2SO4 +2NaOH = Na2SO4 +2H2O (р. обмена)
(Реакции 1,2,3 демонстрируют и составляют на доске уравнения реакций учащиеся под руководством учителя).
4) Качественная реакция на H2SO4.
H2SO4 + BaCl2 = BaSO4 +2HCl (р. обмена)
(Опыт демонстрирует учитель).
5. Особенности конц. H2SO4 (взаимодействие с металлами).
Конц. H2SO4 при нагревании взаимодействует почти со всеми металлами (исключение Au, Pt).
В этих реакциях в зависимости от активности металла и условий выделяются SO2, H2S, S.
Cu + H2SO4 (конц.) = CuSO4 + SO2 + 2H2O
6. Применение серной кислоты.
Учитель дает задание законспектировать применение серной кислоты и подумать над вопросом: почему серную кислоту называют «хлебом» химической промышленности?
Учащиеся смотрят слайд-шоу по мультимедиа и конспектируют в тетради области применения серной кислоты.
6. Закрепление.
1) Перечислите основные химические свойства H2SO4
2) Как бы вы поступили, имея рядом песчаный и меловой карьеры в случае, приведенном в начале урока?
(Ответ: Песок SiO2 — кислотный оксид, с H2SO4 не взаимодействует;
Мел CaCO3 — соль, а H2SO4 реагирует с солями, т.е. нужно было серную кислоту засыпать мелом.
H2SO4 + CaCO3 = CaSO4 + CO2 + H2O )
3) Для автомобильных аккумуляторов используют электролит, который готовят из концентрированной серной кислоты и дистиллированной воды. Как вы будете готовить этот раствор?
4) Самостоятельная работа по разно уровневым карточкам-заданиям.
Во время выполнения задания учитель ходит по рядам, оказывая помощь в выполнении задания слабоуспевающим учащимся.
1-й уровень: 1. С какими веществами вступает в реакцию серная кислота?
Оценка «3» 2. Закончить уравнения реакций, дать названия полученным веществам:
Вариант № 1 Вариант № 2
а) H2SO4 + Fe → а) H2SO4 + Ca→
б) H2SO4 + BaO→ б) H2SO4 + ZnO→
2-й уровень: Вариант № 3.
Оценка «4» 1. Закончить уравнения реакций, дать названия полученным веществам: а) H2SO4 + Al→ б) H2SO4 + Ca(OH)2→
2. Составьте уравнение реакции взаимодействия цинка с концентрированной H2SO4, если один из продуктов реакции SO2.
Вариант № 4.
1. Закончить уравнения реакций, дать названия полученным веществам:
а) H2SO4 + CaCl2→ б) H2SO4 + Al(OH)3→
2. Составьте уравнение реакции взаимодействия железа с концентрированной H2SO4, если один из продуктов реакции SO2.
3-й уровень: Вариант № 5.
Оценка «5». 1. С какими из перечисленных веществ будет взаимодействовать H2SO4:
Al2O3, Au, KOH, CO2, Ni.
Составьте уравнения практически осуществимых реакций.
2. Составьте уравнение реакции взаимодействия цинка с концентрированной H2SO4, если один из продуктов реакции H2S. Расставьте коэффициенты в уравнении методом электронного баланса.
7. Подведение итогов урока.
Учитель обращается к классу:
— какие цели мы ставили на сегодняшнем уроке? (если учащиеся затрудняются ответить, учитель на мультимедиа показывает эти цели).
— достигли ли мы поставленных перед собой целей?
— какие трудности возникли при изучении данного материала?
— какие вопросы не удалось освоить до конца?
— какую оценку вы бы поставили себе за работу на сегодняшнем уроке?
Литература:
Г.Е. Рудзитис, Ф.Г. Фельдман «Химия 9» (М. Просвещение 2009).
«Занимательные опыты по химии». Составитель М.И. Шкурко. Издательство «Народная Асвета» Минск 1968г
Сайты в интернете. Автор и источники заимствования неизвестен.
