Урок 38 / 8 « Чистые вещества и смеси. Способы разделения смесей. Массовая доля вещества в смеси»
( 8 класс – базовый уровень)
Учитель: Дронова Ольга Викторовна
Дата проведения: 18.02.2012 г.
Цели образования:
— сформировать представление о чистом веществе и смеси веществ, раскрыть значение смесей в природе и жизни человека;
— выявить особенности физических свойств чистых веществ и в составе смеси;
— ознакомить со способами разделения смесей на основании физических свойств входящих в их состав компонентов;
— сформировать понятие о массовой доле вещества в смеси, формировать умение рассчитывать массовую долю вещества в растворе и сплаве.
Цели развития:
— развивать умение приводить примеры однородных и неоднородных смесей, предлагать способы разделения смесей на основании физических свойств входящих в них компонентов.
Цели воспитания:
— формировать умение грамотно оформлять тетради;
— формировать умение содержать в чистоте рабочее место;
— формировать умение соблюдать правила техники безопасности при работе с оборудованием и реактивами.
Оборудование:
делительная воронка, спиртовка (1 шт.), химические стаканы, штатив с пробирками, колба для воды, емкость для слива, магнит, воронка, фильтровальная бумага, держатель, фарфоровая чашка, предметное стекло, коллекция минералов, проектор.
Реактивы:
вода, песок, железная стружка, растительное масло, опилки, соль (сахар).
Методы:
использую в сочетании словесно — наглядные методы (беседа, объяснение).
Тип урока:
изучение нового, единичный, отработка дидактических умений, традиционный урок.
| Действия ученика | |
| 1 этап. Мы живем среди химических веществ. Мы вдыхаем воздух.
Что представляет собой воздух?
Какие газы входят в состав воздуха? (слайд).
Умываемся водой — это еще одно вещество, самое распространенное на Земле. Пьём молоко — смесь воды с мельчайшими капельками молочного жира, и не только: здесь еще есть молочный белок казеин, минеральные соли, витамины и даже сахар, но не тот, с которым пьют чай, а особый, молочный — лактоза. Мы не только живем среди химических веществ, но и сами из них состоим. Каждый человек — его кожа, мышцы, кровь, зубы, кости, волосы построены из химических веществ, как дом из кирпичей. Каково происхождение азота, кислорода, сахара, витаминов? Одним из самых любимых материалов скульпторов и архитекторов — мрамор (слайд). Окраска этой горной породы удивительно разнообразна: молочно-белая, серая, розоватая. Причудливый узор радует глаз. Мрамор послушен и податлив в руках мастера, он легко обрабатывается и прекрасно полируется до зеркального блеска. Мрамор — материал, из которого можно изготовить облицовочную плитку, статую или колонну дворца. Плитка, статуя, колонна — это физические тела, изделия. А вот основу мрамора составляет вещество, которое называется карбонат кальция. То же вещество входит в состав других минералов: мела, известняка. А теперь давайте подумаем, почему мрамор бывает разного цвета? Почему на его поверхности играет неповторимый узор? Стекло, резина, сталь – это тоже вещества, точнее, материалы (смеси веществ). И стекло, и резина — искусственного происхождения, в природе их не было. Совершенно чистые вещества в природе не встречаются или встречаются очень редко. Вот и получается, что чистых веществ в природе, в технике, в быту очень немного. Гораздо чаще встречаются смеси — сочетание двух или более веществ. Воздух — это смесь различных газов; нефть — природная смесь органических веществ (углеводородов); любые минералы, горные породы — это тоже твердые смеси различных веществ. Приведите собственные примеры смесей из жизни? Чем же отличаются чистые вещества от смесей веществ? Индивидуальное чистое вещество обладает определённым набором характеристических свойств (постоянными физическими свойствами). Какими свойствами обладает дистиллированная вода? Морская вода замерзает при более низкой, а закипает при более высокой температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более низкой, а закипает при более высокой температуре, чем вода Балтийского моря. Почему? Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов». Рассмотрим сравнительную характеристику чистого вещества и смеси (слайд). |
Воздух – смесь газов.
Это смесь азота, кислорода, углекислого газа.
Азот, кислород, сахар, витамины – вещества природного, естественного происхождения.
Потому что помимо карбоната кальция в его состав входят примеси, придающие окраску, которые содержатся в любых соотношениях.
Зубная паста, шампунь, туман.
Дистиллированная вода имеет tпл = 0 °С, tкип= 100 °С, не имеет вкуса, запаха, цвета.
Дело в том, что в морской воде содержатся другие вещества, например растворенные соли, т.е. она представляет собой смесь различных веществ, состав которой меняется в широких пределах, свойства же смеси не являются постоянными.
Записывают определение. |
Сравнительная характеристика смеси и чистого вещества
| Чистое вещество | Смесь | |
| Состав | Постоянный | Непостоянный |
| Вещества | Одно и то же | Различные |
| Физические свойства | Постоянные | Непостоянные |
| Изменение энергии при образовании | Происходит | Не происходит |
| Разделение | С помощью химических реакций | Физическими методами |
|
Одни частицы настолько велики, что их можно видеть невооруженным глазом. Другие – абсолютно не видны в растворах.
Находят определения, записывают в тетради.
|
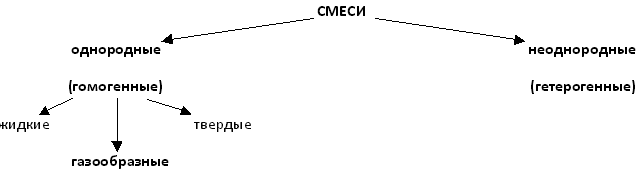
|
Записывают схему. |
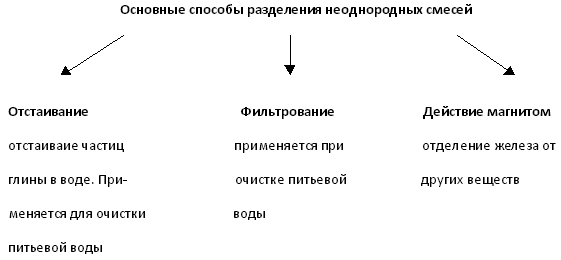
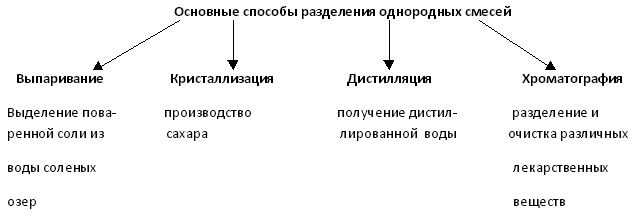
|
Называют правила техники безопасности. Выпаривание проводят самостоятельно.
Гомогенные, гетерогенные. Наличие или отсутствие видимых глазом частиц.
Предлагают способы разделения. |
| Шампуни, напитки, микстуры, препараты бытовой химии.
Горные породы.
Природный газ, воздух. |

Пример решения задачи:
Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора?
Решение:
| Решение: 1. Запишем формулу для расчёта массовой доли:
2. Преобразуем формулу и вычислим массу растворённого вещества в растворе m растворённого вещества = (wрастворённого вещества · mраствора) / 100% m растворённого вещества = (5 % · 300 г) / 100% = 15 г 3. Вычислим массу растворителя – воды: m раствора = m растворённого вещества + m (H2O) m (H2O) = m раствора — m растворённого вещества = 300 г — 15 г = 285 г Ответ: Для приготовления 300 г 5% раствора надо взять 15 г соли и 285 г воды.
|
| Найти: m (H2O) = ? m растворённого вещества = ? |
Д/з. §24, задача: Вычислите массовую долю растворённого вещества, если в 88г воды растворили 12г соли.
