План учебного занятия № 14
Дата Предмет химия группа
Ф.И.О. преподавателя: Кайырбекова И.А.
І. Тема занятия: Общая характеристика неметаллов. Элементы V А группы. Важнейщие соединения азота. Фосфор и его соединения
Тип занятия:урок усвоение новых знании
Цель: обобщить знания обучающихся о свойствах элементов VА группы, их роли в природе и жизни человека; подготовить обучающихся к проведению контрольной работы по данной теме.
Задачи:
I. Образовательные.
Выявление, корректировка и обобщение знаний обучающихся об азоте и фосфоре как об элементах и простых веществах, их нахождении в природе, физических и химических свойствах, способах получения и применения.
Закрепление и углубление знаний обучающихся о соединениях элементов VА группы, их составе и способах получения.
Закрепление и расширение знаний о связи химии с практической жизнью.
II. Воспитательные.
Воспитание чувства коллективизма, ответственности перед коллективом за выполняемую работу.
Экологическое воспитание на основе знаний о круговоротах азота и фосфора в природе, их значении для жизни на Земле.
Формирование у обучающихся научного мировоззрения.
III. Развивающие.
Развитие познавательного интереса к химии.
Развитие логического мышления обучающихся на примерах сравнения, анализа, умений находить и исправлять ошибки, обобщать, делать выводы.
Развитие речи, памяти, внимания, воображения.
ІІ. Ожидаемые результаты:
А) Учащиеся должны знать: о свойствах элементов VА группы
Ә) Учащиеся должны уметь: писать уравнения реакции
б) учащиеся должны владеть:работы с химическими реактивами
ІІІ. Метод и приемы каждого этапа занятия: проблемные, поисковые, лабораторная работа, самостоятельная работа учащихся.
IV. Средства:интерактивная доска
Ход урока
І. Организационная часть Проверить посещяемость учащихся. Озна комление с целью и задачами сегодняшнего занятия. Постановка цели урока.
ІІ. Повторение и обобщение знании 135 стр 10-б 140 стр 5
Б) Фронтальный опрос по лекции.
ІІІ. Объяснение: Общая характеристика неметаллов- элементы V А группы.
К ним относятся азот, фосфор, мышьяк, сурьма и висмут. Особенно большое значение из них имеют азот и фосфор. На последнем энергетическом уровне у них 5 электронов, высшая степень окисления+5, наименьшая -3. Общая оксидная формула R2O5 и водородные соединения с общей формулой RH3
| азот | фосфор | |||
| Положение в П.С. | 2 малый период, элемент V А группы | элементV А группы, 3 малого периода. | ||
| Строение атома | N (7p+;7n)7e— 1s22s22p3 | P(15p+;16n)15e— 1s22s22p63s23p3 | ||
| Нахождение в природе | Встречается в виде соединении и в свободном виде. Входит в состав атмосферного воздуха | Активный, только в виде соединении встречается. В состав минералов. | ||
| получение | NH4NO3= N2+ 2H2O NaNO2+NH4Cl= N2+NaCl+2H2O | 2Ca3(PO4)2+10C+6SiO2=6CaSiO3+ P4+10CO 6P+5KClO3=5KCl+3P2O5 | ||
| физические свойства | Газ без цвета и запаха, низкая температура плавления и кипения. Немного легче воздуха. | Белый фосфор: твердое кристаллическое вещество, бесцветный с желтоватым оттенком, чесночным запахом, сильный яд. Красный фосфор: порошкообразное вещество, темно-красного цвета. | ||
| Химические свойства | Реагирует:
| С простыми веществами: кислородом, галогеном, серой, металлами. Задание дописать уравнения реакции | ||
| Соединение их характер | ||||
| Аммиак- бесцветный газ с резким запахом, хорошо растворим в воде. Аммиак- активное вещество: А) при нагревании 2NH3= N2 +3H2 Б) горит 4NH3+3O2=2N2+6H2O В) окисляется кислородом воздуха 4NH3+5O2=4NO+6H2O г) с водой NH3+HOH= NH4OH д) с кислотами NH3+HCl=NH4Cl | Оксид фосфора- Р2О5— белый, рыхлый порошок, чрезвычайно гигроскопичен. Как кислотный оксид реагирует с водой, с основными оксидами, щелочью. | |||
| Оксид азота (ІІ)— бесцветный газ плохо растворим в воде. N2+О2=2NO 4NH3+ 5O2=4NO+6H2O Оксид азота (IV)- коричневого цвета газ. 2NO2=NO4 2NO2+H2O=2HNO3+NO 2NO2+2NaOH=NaNO3+NaNO2+H2O 4NO2+O2+2H2O=4HNO3 |
| |||
| Азотная кислота | Фосфорная кислота | |||
| HNO3— бесцветная дымящая жидкость с резким раздражающим запахом.
| Н3РО4— твердое, бесцветное, кристаллическое вещество, хорошо растворим в воде. | |||
| Как и все кислоты они подвергаются диссоциации, реагируют с основаниями, основным оксидом, солями слабых кислот. | ||||
| Разлагается : 4NO2+O2+2H2O=4HNO3 С активными металлами: 3Mg+8HNO3=3 Hg(NO3)2+2NO2+4H2O С неактивными: Hg+4HNO3= Hg(NO3)2+2NO2+2H2O | Качественная реакция H3PO4+3AgNO3= Ag3PO4+3HNO3 | |||
IV. Закрепление знаний:
Закрепления: 153 стр № 1 упр
Игра — Лабиринт
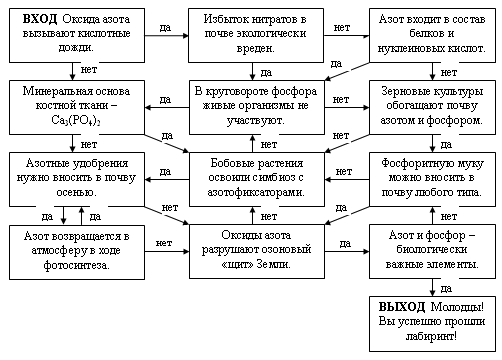
V. Домашнее задание: 153 стр №2, 158 стр №6 упр
