Конкурс конспектов уроков учителей естественных предметов и географии «Урок XXI века».
«СЕРА – ХИМИЧЕСКИЙ ЭЛЕМЕНТ И ПРОСТОЕ ВЕЩЕСТВО»
(урок по химии 9 кл.)
Разработан учителем химии
МБОУ СОШ №36 г. Владимира
Родионовой Еленой Сергеевной
2011 г.
Школа: МБОУ СОШ №36 г. Владимир
Класс: 9
Предмет: химия Родионова Елена Сергеевна, учитель химии высшей квалификационной категории
Тема: «Сера – химический элемент и простое вещество»
Авторы и название УМК: программа Н.Е.Кузнецова
Тип урока: урок изучения нового материала
Методы: технология развития критического мышления; ИКТ.
Методические приёмы, используемые на уроке: составление кластера, составление таблицы «Что знал? Что узнал нового?», самостоятельная работа с учебной литературой, беседа, химический эксперимент, самопроверка.
Формы организации познавательной деятельности: фронтальная, групповая
Средства обучения: проектор, компьютер, слайдовая презентация
Цели урока.
Обучающие — рассмотреть положение элемента серы в ПСХЭ Д.И.Менделеева, строение атома; аллотропные видоизменения серы; физические и химические свойства; применение серы и ее соединений человеком.
Развивающие – развивать интеллектуальные и познавательные умения учащихся добывать самостоятельно знания, обобщать и делать выводы, фиксировать главное в свернутом виде.
Воспитательные – содействовать воспитанию организованности учащихся при решении проблемных вопросов.
Учащиеся должны знать: строение атома серы, физические и химические свойства аллотропных видоизменений серы, области применения.
Учащиеся должны уметь: давать характеристику серы, как химического элемента, так и простого вещества.
Оборудование: учебник Кузнецова Н.Е.Химия, 9 класс, задачник по химии Кузнецовой Н.Е.». ПСХЭ, компьютер, проектор, экран, демонстрация эксперимента с мультимедийного слайда, цветные карточки – задания для групп, сваренное яйцо, кусочек серы, стакан с водой.
Ход урока.
| Структурный элемент урока | Деятельность учителя | Деятельность учащегося | ||||||||||||||||||||||||||||||||||||||||||
| 2 мин | Стадия I. Вызов.
(слайды 1, 2, 3)
Слайд 4 | Мы продолжаем изучение отдельных элементов периодической системы Д.И.Менделеева, и я не сомневаюсь в том, что вас ждут сегодня открытия, потому что, по словам Ж.Пиаже, “понять что-либо значит открыть вновь”. Урок посвящен одному из самых интересных элементов. Этот элемент и его соединения известны с глубокой древности. Этот элемент — начало начал древнейших философов и алхимиков; он окутан мистикой и тайнами. Люди наделяли его таинственными, сверхъестественными свойствами. Ее алхимический символ-крест и треугольник, обращенный острием вверх — знак огня. Другие знаки для этого элемента в алхимии – буква, являющая собой форму спирали, или извивающейся змеи и молнии. Она бывает представлена пересечением двух спиралей, напоминающее собой свастику – символ движения – или знаком трезубца. Все эти знаки известны в алхимии как символы огня, языки которого направлены к небу. Вы все знакомы с этим элементом, если хоть раз держали в руках петарды, краски, спички, видели фейерверки. Более того, каждый из нас носит в себе примерно 140 г этого элемента, конечно, в виде химических соединений. Входит в состав белков, витаминов, гормонов, присутствует в нервных тканях, хрящах, обнаружена в крови, моче, слюне, молоке. При его недостатке в организме отмечается хрупкость и ломкость костей, выпадение волос.
Определите этот элемент по его положению в периодической системе химических элементов Д. И. Менделеева (3 период, VI группа). — Как тогда можно сформулировать тему урока? — Нам сегодня предстоит ответить на вопрос: «Что мы можем рассказать о сере ученикам 8 класса?» | .
Предполагаемый ответ: Сера.
Предполагаемый ответ: Тема урока: «Сера – химический элемент и простое вещество». | |||||||||||||||||||||||||||||||||||||||||
| 2 мин |
| Свойства серы описаны в повести А.М.Волкова «Царьградская пленница» (Приложение 1» — Как бы вы прокомментировали этот отрывок?
|
читают текст | |||||||||||||||||||||||||||||||||||||||||
| 2мин
| Приём «Корзина идей»
Слайд 5
| — Запишите в тетрадях всё о сере, что вы сейчас можете вспомнить. — Обсудите со своим соседом вашу информацию и запишите в таблицу. — Что у вас получилось?
| Зачитывают результаты работы в парах. Один – два ученика зачитывают, остальные сверяют, отмечают, какие у них есть аналогичные слова, каких слов нет. Предполагаемые ответы: Положение в ПСХЭ, группа, период, строение атома, состав, распределение электронов, электронная конфигурация, химическая связь, простое вещество. Запись в тетрадь таблицы.
| |||||||||||||||||||||||||||||||||||||||||
| 2мин. | Прием «Составление кластера»
| Учитель записывает на доске, где в центре записано ключевое понятие урока «Сера». В процессе обсуждения с учениками слова–ассоциации с заданным понятием фиксируются в пустых овалах в порядке озвучивания. Затем объекты — ассоциации выделяются, перемещаются, производится их систематизация по группам на основе общности признака. Результат – наглядное представление ключевого понятия. — Что мы не знаем? Что хотим узнать? На кластере показываем знаком вопроса «?»
| Ученики зачитывают слова, составляют кластер | |||||||||||||||||||||||||||||||||||||||||
| 2 мин | Стадия II. Осмысление
Слайд 6
| — Какие уже известные нам понятия мы не отметили на кластере? Обсудите ответ в парах. Запишите в таблицу.
Добавление кластера. — Добавим эти сведения в кластер (выделение на доске и на слайде презентации другим цветом).
| Предполагаемые ответы:
Запись в таблицу.
| |||||||||||||||||||||||||||||||||||||||||
| 10 мин |
| Анализируя сказанное и добавленное вами, мы можем определить цель нашего урока: дать характеристику сере как химическому элементу и как простому веществу. Работать будем в группах, каждая группа выбирает задание по цвету: белый – фактическое задание, голубой – экспериментальное задание, зелёный – творческое задание. ( Приложение 2).На подготовку ответов выделяется 10 минут. Во время работы каждая группа составляет свой опорный конспект. Затем слушаем отчеты групп (Во время работы групп учитель оказывает помощь нуждающимся.). После работы в группах проводится физкультминутка. | Расходятся по группам Работают в группах
Выполняют 2-3 физических упражнения | |||||||||||||||||||||||||||||||||||||||||
| 2 мин | Слайд 7 | Каковы же особенности неметалла серы? Какое строение имеет атом серы. |
Ответ одного обучающегося из первой группы; заполнение таблицы
| |||||||||||||||||||||||||||||||||||||||||
| 2мин | Слайды 8,9,10,11, 12, 13 | — Что представляет собой сера как простое вещество? — Характерно ли для серы явление аллотропии?
Добавим новые понятия в кластер (отмечаем красным цветом на доске) физические свойства аллотропных модификаций
| Ответ одного обучающегося из второй группы;
заполнение таблицы | |||||||||||||||||||||||||||||||||||||||||
| 5 мин | Приём «Концептуальная таблица» Слайд 14 | Чтобы сравнить аллотропные модификации серы, заполним таблицу, в которой отмечены линии сравнения аллотропных модификаций серы.
| Учащиеся выполняют задание, с помощью компьютера, в группах. Таблица для сравнения выводится на экран. Обсуждение заполненной таблицы каждой группой учащихся коллективно. | |||||||||||||||||||||||||||||||||||||||||
| 5мин | Слайды 15, 16, 17 | — С какими веществами может взаимодействовать сера как типичный неметалл? — Какие свойства (окислительные, восстановительные) будет проявлять сера в химических реакциях?
Рассмотрите записанные уравнения химических реакций с точки зрения окислительно-восстановительного процесса. | Предполагаемые ответы:
с водородом; с кислородом; с галогенами;
Ответ одного обучающегося из третьей группы; заполнение таблицы
Один ученик работает у доски, затем проверка. | |||||||||||||||||||||||||||||||||||||||||
|
| Добавление кластера.
| — Добавим новые сведения в кластер (выделение на доске красным цветом). Окислительно-восстановительные свойства |
| |||||||||||||||||||||||||||||||||||||||||
| 2мин | Слайды 18, 19, 20, 21 | — В каком виде сера встречается в природе? — Как вы думаете, а в живой природе сера встречается? — Какие вещества, жизненно необходимые каждому организму, содержат элемент серу? Как это можно доказать?
| Предполагаемый ответ:
Ответ одного обучающегося из пятой группы; заполнение таблицы
| |||||||||||||||||||||||||||||||||||||||||
|
| Добавление кластера.
| — Добавим новые сведения в кластер (выделение на доске красным цветом). Нахождение в природе Биологическое значение
|
| |||||||||||||||||||||||||||||||||||||||||
| 2мин | Слайды 22, 23, 24 | Итак, мы рассмотрели свойства серы как индивидуального простого вещества, а ими, как вы знаете, определяются области применения. Каковы же они?
— Добавим новые сведения в кластер (выделение на доске красным цветом). Применение | Ответ одного обучающегося из четвёртой группы; заполнение таблицы
| |||||||||||||||||||||||||||||||||||||||||
| 2мин | Стадия III. Рефлексия
| Учитель: Подошел к концу наш урок. Обратимся к своим записям в колонке «Что знал?», сделанным ранее. — Что мы знали по этой теме? — Что узнали нового по этой теме на уроке?
|
Через компьютер на экран выводится таблица. Ученики зачитывают колонки таблицы.
| |||||||||||||||||||||||||||||||||||||||||
|
|
| — Вся информация по теме: «Сера – химический элемент и простое вещество» представлена в кластере. — Как вы думаете, можно ли использовать данный кластер при изучении других химических элементов? |
Предполагаемый ответ: Да, так как каждый элемент характеризуется по этим признакам.
| |||||||||||||||||||||||||||||||||||||||||
| 2мин |
| — Смогли ли мы ответить с вами на вопрос урока? (Что мы можем рассказать о сере ученикам 8 класса?); — Что вызвало затруднения? Как мы теперь прокомментируем отрывок из книги А.М. Волкова «Царьградская пленница» (приложение 1). |
Комментируют отрывок (записывают уравнения упомянутых в тексте реакций). | |||||||||||||||||||||||||||||||||||||||||
| 1мин |
| — Какие вопросы вы бы задали по этому поводу? — А как вы думаете, мы всё уже знаем о неметалле сера? — А что, по вашему мнению, нам ещё предстоит узнать о сере? | Предполагаемые ответы:
| |||||||||||||||||||||||||||||||||||||||||
|
|
| -Часть материала мы уже изучали ранее. Нам необходимо его повторить при выполнении домашнего задания.
|
| |||||||||||||||||||||||||||||||||||||||||
| 1мин | Домашнее задание.
| Параграф 25, вспомните:
Запишите ответы на вопросы в колонке «Знал».
|
| |||||||||||||||||||||||||||||||||||||||||
| 1мин | Слайды 25, 26 | Что вам на уроке удалось лучше всего? — Что вам понравилось на уроке? — С каким настроением заканчиваете урок? Я хотела бы закончить урок напутствием Дмитрия Ивановича Менделеева Сами, трудясь, вы сделаете все и для близких людей и для себя, а если при труде успеха не будет, неудача – не беда, попробуйте ещё. |
| |||||||||||||||||||||||||||||||||||||||||
Приложение 1.
Информационный материал
Текст.
Около 680 г. н.э. в морском бою против арабов византийцы впервые применили новое ужасное оружие – “греческий огонь”. Галеры византийцев выбрасывали на неприятельские суда заранее подожженную смесь из “пифонов” – установок, подобных огнеметам. Суда пылали как факелы, а огонь нельзя было потушить водой. Смесь горела на морских волнах, прилипала к корпусам судов и одежде людей. В 941 г. под стенами Царьграда “греческим огнем” был уничтожен флот киевского князя Игоря. Строки летописи в переводе на современный язык звучат так: “Словно молнию, которая в небе, греки имеют у себя и пускают ее, сжигая нас, поэтому мы не одолели их”. В состав “греческого огня” входили битум или нефть, а также неметалл Э. Этот неметалл на воздухе горит красивым сине-голубым пламенем, выделяя удушливый и едкий газ. При обработке концентрированной азотной кислотой неметалл Э превращается в сильную кислоту Н2ЭО4,оксид азота(IV) и воду. При кипячении неметалла с солью состава Na2ЭО3 в растворе появляется другая соль, состава Na2ЭО3Э. Назовите неметалл Э.
О т в е т. Э – сера.
Уравнения упоминаемых в тексте реакций:
S + 6HNO3 = Н2SО4 + 6NO2 + 2H2O,
![]()
Приложение 2.
Задания для групп.
Группа 1. (жёлтая карточка)
Рассмотрите положение серы в периодической системе химических элементов и строение ее атома по предложенному плану. Объясните, почему в отличие от кислорода, для серы характерно проявление в соединениях степени окисления +4 и +6?
Оборудование: план характеристики химического элемента по периодической системе химических элементов Д. И. Менделеева. (Приложение 3).
Группа 2. (голубая карточка)
Рассмотрите серу как простое вещество и докажите ее физические свойства на примере выданного вам образца. Объясните, особенности строения аллотропных модификаций серы, определите различия в их физических свойствах. В чем причина различия в свойствах? Какие новые понятия вы узнали из текста? Заполните колонку «Что узнали нового?», сохраняя логическую связь понятий.
Оборудование: кусочек серы, стакан с водой. (Приложение 4).
Группа 3. (желтая карточка)
Изучите химические свойства серы и составьте схему, отражающую особенности химических свойств серы как окислителя и восстановителя. Объясните, почему сера может проявлять окислительные и восстановительные свойства.
Какие новые понятия вы узнали из текста? Заполните колонку «Что узнали нового?», сохраняя логическую связь понятий.
Оборудование: §25 стр. 75– 76 учебника Н.Е.Кузнецовой «Химия 9 класс».
Группа 4. (зеленая карточка)
Прочитайте отрывок первой части XVII главы романа А. Дюма «Граф Монте-Кристо»: «И аббат показал Дантесу плошку, вроде тех, которыми освещают улицы в торжественные дни. «А огонь?» — «Вот два кремня и трут, сделанный из лоскута рубашки». – «А спички?» — «Я притворился, что у меня накожная болезнь, и попросил серы; мне ее дали».
Какие области применения серы упомянуты в отрывке из романа Александра Дюма «Граф Монте-Кристо», и на каких свойствах серы они основаны? Изучите материал о применении серы.
Какие новые понятия вы узнали из текста? Заполните колонку «Что узнали нового?», сохраняя логическую связь понятий.
Оборудование: §25 стр. 76 учебника Н.Е.Кузнецовой «Химия 9 класс».
Группа 5. (зелёная карточка) Изучите материал о нахождении серы в природе; рассмотрите коллекцию; из разбросанных кубиков соберите схему «Нахождение серы в природе».
Как вы думаете, встречается ли сера в живой природе?
Какие вещества, жизненно необходимые каждому организму, содержат серу? Как это можно доказать? Исследуйте вареное куриное яйцо. Отметьте окраску внутренней поверхности свернувшегося белка; сделайте вывод о химическом составе белка.
Заполните колонку «Что узнали нового?», сохраняя логическую связь понятий.
Оборудование: Приложение 5; набор кубиков, коллекция минералов, вареное яйцо, чашка Петри.
Приложение 3.
План характеристики химического элемента по периодической системе химических элементов Д. И. Менделеева
1. Определите положение химического элемента в периодической системе (номер периода, номер группы, подгруппу) и семейство химических элементов, к которому он принадлежит (s, p,d,f-элемент).
2. Опишите строение атома химического элемента (в основном состоянии):
а) определите число протонов, нейтронов и электронов в атоме;
б) напишите полную электронную формулу и характеристическую электронную формулу химического элемента, приведите орбитальную диаграмму электронной оболочки атома;
в) приведите варианты распределения валентных электронов по орбиталям и укажите количество неспаренных электронов в возбуждённых состояниях атома, укажите характерные степени окисления элемента.
3. Опишите свойства простых веществ:
а) определите принадлежность простых веществ к металлам или неметаллам, приведите уравнения реакций, характеризующих свойства простых веществ.
4. Опишите свойства наиболее характерных сложных веществ:
а) водородных соединений: химические формулы, приведите уравнения реакций, характеризующие кислотно-основные и окислительно-восстановительные свойства;
б) оксидов и гидроксидов: химические формулы, химический характер, приведите уравнения реакций, характеризующие кислотно-основные и окислительно-восстановительные свойства
Приложение 4.
Физические свойства серы.
Сера – твердое кристаллическое вещество желтого цвета. Как и все неметаллы, она плохо проводит теплоту и не проводит электрический ток. Кусочки серы тонут в воде – ее плотность близка к 2, а порошок серы всплывает, так как не смачивается водой.
Подобно сере в измельченном состоянии водой не смачиваются многие природные соединения. Этим свойством пользуются для отделения сернистых руд от «пустой породы». Такой метод обогащения руд называется флотацией и широко используется на практике.
Сера в воде практически не растворяется. Хорошими растворителями для нее являются сероуглерод, толуол и некоторые другие вещества.
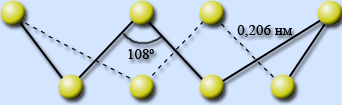
Сера имеет несколько аллотропных модификаций. Наиболее устойчивы ромбическая и моноклинная. Это кристаллические вещества, которые различаются формой кристаллов и некоторыми физическими свойствами
|
|
ромбическая моноклинная
Кристаллы состоят из молекул S8(кр. решетка молекулярная – неполярная)
(ромбическая) имеет цвет лимонно-желтый, tпл.=112,8C, 3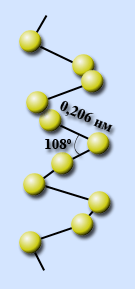
(моноклинная) имеет цвет темно-желтый tпл.=119.3C, 3
При быстром охлаждении расплавленой серы образуется ещё одна неустойчивая аллотропная модификация — пластическая сера Sn , которая легко растягивается подобно резине.
S S S S S
/ / / / /
..S S S S S S…
Приложение 5.
Нахождение в природе
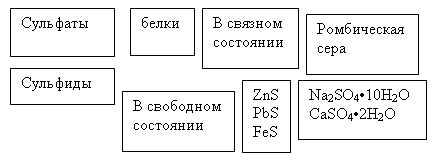
Сера довольно широко распространена в природе. В земной коре ее содержание оценивается в 0,05% по массе. В природе часто встречаются значительные залежи самородной серы (обычно вблизи вулканов); в Европе они расположены на юге Италии, в Сицилии. Большие залежи самородной серы имеются в США (в штатах Луизиана и Техас), а также в Средней Азии, в Японии, в Мексике. В природе сера встречается как россыпями, так и в виде кристаллических пластов, иногда образуя изумительные по красоте группы полупрозрачных желтых кристаллов (так называемые друзы).
В вулканических местностях часто наблюдается выделение из-под земли газа сероводорода H2S; в этих же регионах сероводород встречается в растворенном виде в серных водах. Вулканические газы часто содержат также сернистый газ SO2.
На поверхности нашей планеты широко распространены месторождения различных сульфидных соединений. Наиболее часто среди них встречаются: железный колчедан (пирит) FeS2, медный колчедан (халькопирит) CuFeS2, свинцовый блеск PbS, киноварь HgS, сфалерит ZnS и его кристалическая модификация вюртцит, антимонит Sb2S3 и другие. Известны также многочисленные месторождения различных сульфатов, например, сульфата кальция (гипс CaSO4·2H2O и ангидрит CaSO4), сульфата магния MgSO4 (горькая соль), сульфата бария BaSO4 (барит), сульфата стронция SrSO4 (целестин), сульфата натрия Na2SO4·10H2O (мирабилит) и др.
Каменные угли содержат в среднем 1,0-1,5% серы. Сера может входить и в состав нефти. Целый ряд месторождений природного горючего газа (например, Астраханское) содержат как примесь сероводород.
Сера относится к элементам, которые необходимы для живых организмов, так как она является существенной составной частью белков. Белки содержат 0,8-2,4% (по массе) химически связанной серы. Растения получают серу из сульфатов, содержащихся в почве. Неприятные запахи, возникающие при гниении трупов животных, объясняются главным образом выделением соединений серы (сероводорода и меркаптанов), образующихся при разложении белков. В морской воде присутствует около 8,7·10-2 % серы.
Биологическая роль
Сера постоянно присутствует во всех живых организмах, являясь важным биогенным элементом. Ее содержание в растениях составляет 0,3-1,2 %, в животных 0,5-2 % (морские организмы содержат больше серы, чем наземные). Биологическое значение серы определяется прежде всего тем, что она входит в состав аминокислот метионина и цистеина и, следовательно, в состав пептидов и белков. Дисульфидные связи –S–S– в полипетидных цепях участвуют в формировании пространственной структуры белков, а сульфгидрильные группы (–SH) играют важную роль в активных центрах ферментов. Кроме того, сера входит в молекулы гормонов, важных веществ. Много серы содержится в кератине волос, костях, нервной ткани. Неорганические соединения серы необходимы для минерального питания растений. Они служат субстратами окислительных реакций, осуществляемых распространенными в природе серобактериями.
В организме среднего человека (масса тела 70 кг) содержится около 1402 г серы. Суточная потребность взрослого человека в сере — около 4.
