Тема урока: «Валентность и степень окисления атомов»
Цель урока: Определить понятие валентности и степени окисления атомов.
Задачи:
обучающие: Научить учащихся работать с основным понятийным аппаратом, схемами, карточками, решать расчетные задачи.
развивающие: Способствовать развитию речи, овладеть основными способами мыслительной деятельности, умением работать в команде, развить познавательный интерес к предмету, формированию самостоятельной деятельности учащихся.
воспитательные: Воспитать нравственные и эстетические качества учащихся, правильное отношение к мнению одноклассников.
Основные понятия. Валентность, степень окисления атомов.
План урока:
Организационный момент.
Подготовка к объяснению нового материала.
Изложение нового материала.
Закрепление темы.
Домашнее задание.
Ход урока:
1. Здравствуйте, ребята! Кто сегодня на уроке отсутствует?
2. Тема нашего урока для вас уже знакома. В курсе химии 8 класса мы уже говорили о валентности и о степенях окисления. Сегодня мы будем вспоминать то, что знаем и узнавать то, что раньше не изучали.
3. Итак, что же такое валентность?
Валентность – одно из основных понятий химии, которое было введено в науку в середине 19в.
Валентность – это свойство атомов химического элемента присоединять определенное число атомов других химических элементов, или валентность – это способность атомов образовывать соединения.
Это определение ввел английский химик Э. Франкленд в 1852 г. как понятие о соединительной силе. Оно использовалось Д.И.Менделеевым как одно из главных свойств атома при установлении периодического закона. Валентность характеризует способность атомов элементов соединяться с другими атомами.
За единицу валентности принята валентность атома водорода. Атом водорода не присоединяет больше одного атома другого элемента. Это видно из химических формул следующих соединений HCl, HBr, H2S, PH3, CH4. Можно графически представить эти формулы так:
H
|
H–Cl, H–Br, H– S–Н, H–Р–Н, Н–C–H.
| |
Н H
Черточки в формулах условно обозначают связи между атомами. Сколько связей может образовать атом, такова его валентность.
Физический смысл термина валентность стал понятен с развитием учения о строении атомов и химической связи. Атомы элементов могут вести себя по–разному: отдавать или присоединять электроны, образовывать общие электронные пары. Электроны, которые участвуют в образовании химической связи между атомами, называются валентными.
у химических элементов общее число валентных электронов в атоме равно номеру группы ПС, в которой находится элемент.
К валентным относятся, прежде всего, электроны внешних незавершенных уровней. Однако валентными могут быть и электроны второго снаружи уровня. Значения высших валентностей элементов имеют четкую периодическую зависимость от величины заряда ядра. В связи с этими данными определение валентности изменилось.
Валентность определяется как число химических связей, которыми данный атом соединен с другими атомами.
Для характеристики состояния атомов в соединениях введено понятие степени окисления.
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов.
Степень окисления может иметь отрицательное, положительное и нулевое значения, которые обычно выражаются арабскими буквами со знаками и ставят над символом элемента, например:
![]()
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, то есть атомы более электроотрицательных атомов.
![]()
Отрицательная, или низшая, степень окисления определяется числом электронов, которые атом может принять для завершения внешнего энергетического уровня до устойчивого состояния(8 электронов). Ее можно вычислить по формуле 8 — №гр. Отрицательные степени окисления имеют элементы – неметаллы.
Положительную степень окисления имеют атомы, которые отдают свои электроны другим атомам. Высшая положительная степень окисления проявляется, когда в образовании связи принимают участие все валентные электроны атома. Численно она равна, номеру группы ПС и является важной количественной характеристикой элемента в его соединениях. Исключение составляют фтор, кислород, гелий, аргон, железо и элементы подгруппы кобальта и никеля, высшая валентность которых ниже, чем номер группы. Металлы в соединениях всегда имеют положительную степень окисления.
Нулевое значение степени окисления может быть у атомов в молекулах простых веществ, например в молекулах кислорода, фтора, водорода, хлора, так как в этом случае электроны в равной мере принадлежат обоим атомам. Степень окисления атомов в простом веществе равно нулю.
Степень окисления может представлять собой и дробное число. Такие значения степеней окисления могут быть использованы для составления ОВР.
Атомы в соединениях могут иметь и промежуточные степени окисления.
Изменения степеней окисления элементов по группам периодической счистемы соответствует периодичности изменения химических свойств элементов с ростом заряда ядра.
Зная степень окисления элемента в соединениях, можно предсказать, окислительные и восстановительные свойства проявит этот элемент и его соединение.
Степень окисления часто не совпадает с валентностью, т.к. во многих соединениях степень окисления атома элемента не совпадает с числом образуемых им связей
По формулам большинства неорганических соединений можно судить о степени окисления, а не о валентности.
4. ![]()
Определите степень окисления в следующих соединениях:
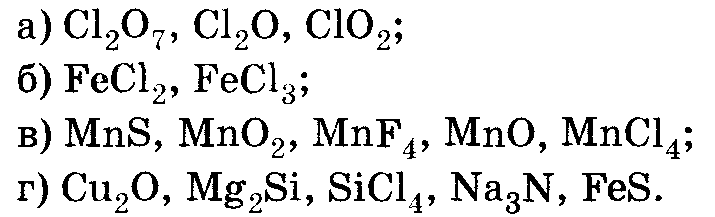
5. Домашнее задание: § 2.9, стр. 79 № 6, 7, 8.
