Программа элективного курса в рамках предпрофильной
подготовки учащихся 9 классов
Определение совместимости бытовых чистящих средств
Валеева Елена Николаевна
учитель химии I кв. категории
МОУ «Гимназия №32» г. Нижнекамска РТ
Пояснительная записка
Курс «Определение совместимости бытовых чистящих средств» предназначен для учащихся 9 классов и имеет практическую направленность, знакомит с основами исследовательской деятельности. Курс рассчитан на 12 часов и ориентирован на расширение кругозора учащихся, на развитие любознательности. Этот курс не дублирует базовый курс химии, он ориентирует школьников на осознанный выбор профиля обучения и поможет сделать собственный выбор по пути дальнейшего профессионального образования. В программу включен как теоретический материал, так и практические занятия. Практические работы проводятся учащимися в группах по 2-3 человека, используются чистящие средства бытовой химии, принесенные ребятами из дома.
Цель курса: способствовать самоопределению ученика для определения профиля обучения в старших классах.
Задачи курса:
развитие познавательных интересов школьников;
развитие интеллектуальных и творческих способностей в процессе самостоятельной работы;
возможность для самореализации в учебной деятельности;
воспитание навыков сотрудничества в процессе совместной работе;
развитие умений учащихся выполнять химический эксперимент в соответствии с требованиями техники безопасности;
Формы обучения: урок-лекция, урок — практическое занятие.
Ожидаемые результаты:
получение новых представлений о бытовой химии, их совместимости при домашнем применении;
расширение опыта исследовательской деятельности;
развитие познавательного интереса;
осознанный выбор профиля дальнейшего обучения.
Форма отчетности: презентация творческих проектов
Тематический план
|
название темы | количество часов |
форма занятий | ||
| теория | практика | |||
| 1 | Введение. Общая характеристика чистящих средств. | 1 |
| лекция |
| 2 | Растворы, качественная и количественная характеристика | 1 |
| лекция, практикум по решению расчетных задач |
| 3 | Приготовление раствора с определенной концентрацией. |
| 1 | беседа, практическая работа№1 |
| 4 | Вредные вещества, входящие в состав средств бытовой химии и их влияние на здоровье человека | 1 |
| лекция |
| 5 | Изучение состава чистящих средств по промышленным этикеткам |
| 1 | беседа, практическая работа№2 |
| 6 | Изучение несовместимости средств по составу | 1 |
| лекция, де-монстрационный эксперимент |
| 7 | Определение среды растворов чистящих веществ |
| 1 | беседа, практическая работа№3 |
| 8 | Определение наличия хлора в чистящих веществах |
| 1 | беседа, практическая работа№4 |
| 9 | Определение наличия карбонат-иона в чистящих веществах |
| 1 | беседа, практическая работа№5 |
| 10 | Определение наличия ионов аммония в чистящих веществах |
| 1 | беседа, практическая работа№6 |
| 11 | Безопасная бытовая химия | 1 |
| лекция |
| 12 | Презентация творческих проектов. | 1 |
|
|
|
| Итого | 6 | 6 |
|
Содержание программы
Занятие 1. Введение. Общая характеристика чистящих средств.
Состав чистящих средств: ПАВ (поверхностно-активные вещества), абразивные и безабразивные вещества; анионо- и катионоактивные вещества, ферменты. Агрегатное состояние чистящих средств: порошкообразные, жидкие, в виде гелей и пастообразные. Вредные вещества, входящие в состав чистящих средств. Натуральные моющие средства, способы их приготовления
Занятие 2. Растворы, качественная и количественная характеристика.
Способы выражения концентрации растворов: молярность, массовая доля, нормальность. Газовые растворы. Решение задач на вычислении различной концентрации растворов. Вычисление концентрации раствора при смешивании двух растворов одного и того же вещества.
Занятие 3. Приготовление раствора с определенной концентрацией.
Массовая доля, молярная концентрация; единицы измерения. Приготовление раствора определенного состава. Практическая работа№1.
Занятие 4. Вредные вещества, входящие в состав средств бытовой
химии и их влияние на здоровье человека.
Главными источниками случайных отравлений служат дезинфицирующие средства, чистящие средства. Многие ядовитые химические вещества, часто встречающиеся в быту, могут стать причиной отравления. Симптомы отравления. Лечение отравления.
Занятие 5. Изучение состава чистящих средств по промышленным
этикеткам.
Характеристика чистящих средств, которые продаются в нашем городе: состав, меры предосторожности, особенности использования. Практическая работа№2.
Занятие 6. Изучение несовместимости средств по составу.
Согласно анализу химической литературы, в основе большинства процессов лежат химические реакции. Некоторые препараты при совместном использовании теряют свою чистящую способность или образуют новые вещества с новыми свойствами.
Занятие 7. Определение среды растворов чистящих веществ.
Среда раствора, водородный показатель, изменение окраски индикатора раствора в зависимости от его среды. Индикаторы: фенолфталеин, метиловый оранжевый, лакмус, универсальная индикаторная бумага.
Практическая работа№3.
Занятие 8. Определение наличия хлора в чистящих веществах.
Наличие хлорсодержащих ионов в веществах. Влияние хлорсодержащих веществ на организм человека. Качественная реакция на ионы хлора. Практическая работа№4.
Занятие 9. Определение наличия карбонат-ионов в чистящих веществах.
Чистящие свойства карбонат-ионов. Обнаружение карбонат-ионов, качественная реакция на карбонат-ионы. Практическая работа№5.
Занятие 10. Определение наличия ионов аммония в чистящих веществах.
Наличие ионов аммония в чистящем средстве. Качественная реакция на ион аммония. Влияние аммиака на организм человека.
Занятие 11. Безопасная бытовая химия.
Совершенно безопасных соединений вообще не существует. При правильном использовании все препараты бытовой химии безопасны. Работа с химическими веществами не перенесет никакого вреда, если строго придерживаться определённых правил, которые диктуют техника безопасности и здравый смысл.
Занятие 12. Презентация творческих проектов.
Литература для учителя
Астафуров В.И. Основы химического анализа: Учеб. пособие по факультативному курсу для учащихся 9-10 кл.- 2 изд., испр.- М.: Просвещение, 2007.
Горбунова Т.С. Химия вокруг нас. – Омск: Издательство ОмГПУ, 2000
Леенсон И.А.Занимательная химия. Часть 1.- М.: Дрофа,2002
Леенсон И.А.Занимательная химия, часть 2.- М.: Дрофа,2002
Степин Б.Д., Аликберова Л.Ю., Рукк Н.С. Домашняя химия. Химия в быту и на каждый день.- М.: РЭТ, 2001.
Ушакова Н.Н., Николаева Е.Р., Моросанова С.А. Пособие по аналитической химии. Качественный анализ. – М.: Изд-во Моск. ун-та, 2001.
Литература для учащегося
.Астафуров В.И. Основы химического анализа: Учеб. пособие по факультативному курсу для учащихся 9-10 кл.- 2 изд., испр.- М.: Просвещение, 2007.
Балаев И.И. Домашний эксперимент по химии. – М.:Просвещение,2003
Гроссе Э., Вайсмантель Х. Химия для любознательных. – Ленинград, изд-во “Химия”, 2001
Исаев Д.С. Практические работы исследовательского характера по неорганической химии: Учебное пособие для учащихся 9-х классов. — Тверь, 2001.
Савина Л.С. Детская энциклопедия “Я познаю мир. Химия” — Москва, АСТ, 2003
Шульпин Г.Б. Эта увлекательная химия. – Москва, “Химия”, 2001.
Юдин А.М. Химия в нашем доме: Справ. изд.- 2 изд. – М.: Химия, 2000.
Юдин А.М., Сучков В.Н., Коростелин Ю.А. Химия для вас, — 3 изд., стереотипн. – М.: Химия, 2005.
Я познаю мир: Дет.энциклопедия: Химия. /Авт.-сост. Л.А.Савина. – М.: ООО «Изд-во АСТ-ЛТД», 2001.
Приложение
Занятие 1.
Введение. Общая характеристика чистящих средств.
Цель: актуализировать и систематизировать знания учащихся о чистящих средствах.
Лекция.
Наведение чистоты в современном доме невозможно без использования различных средств бытовой химии. Сильнодействующие, концентрированные, едкие, все они требуют осторожного использования и выполнения инструкций. Буквально 10 лет назад люди использовали в качестве моющего и чистящего средства обыкновенное мыло, которое не выполняло требуемых функций. На смену им пришли синтетические моющие, чистящие средства.
Совершенствованию чистящих и моющих средств, способствует не только создание новых средств бытовой химии, но и успехи, достигнутые в изучении механизмов их действия. Изучение механизмов действия различных химических веществ, входящих в состав средств бытовой химии создали новые возможности для направленного синтеза этих препаратов и рационального применения их в быту. Поэтому изучения этих аспектов очень актуально.
Современные чистящие средства есть совокупность разнообразных веществ. Компонентный состав препаратов является главным показателем их эффективности. В их состав входят такие вещества, которые разрушают загрязнения и удалят их с поверхности. О наличии в составе чистящего средства таких соединений сообщается на упаковке. Эти вещества окисляют и тем самым разрушают некоторые виды загрязнителей. Это могут быть как классические окислители — хлор, перекись водорода, но также сильнодействующие (в некоторых случаях вредные) вещества — абразивы, сильные кислоты, щелочи, пербораты. Щелочные добавки способствуют разрушению жировых загрязнений. Эти соединения, выделяют кислород, которые обесцвечивают и окисляют органические соединения, кроме этого дезинфицируют моющую поверхность.
Некоторые вещества, в составе чистящих средств, способствуют образованию сильной пены – это поверхностно-активные вещества. Все поверхностно — активные вещества, входящие в состав чистящих средств являются эмульгаторами. Они способствует образованию эмульсии масла в воде (то есть смешиванию масла и воды), обладают моющими свойствами и образуют пену – ведь пена как бы является эмульсией воздушных пузырьков в воде. Но не все эти свойства выражены у них одинаково. Есть поверхностно-активные вещества, которые обильно образовывают пену, но является слабыми средствами; есть и такие которые почти не пенятся, но представляют собой прекрасные чистящие средства.
Современные средства содержат в больших количествах синтетические детергенты — это синтетические ПАВ с особо высокой моющей и чистящей способностью.
В зависимости от наличия абразивных компонентов все чистящие средства делятся на две группы: абразивные и безабразивные. Абразивные средства в качестве главного компонента содержат природные либо исскуственные мелкодисперсные твердые вещества – абразивы. К первым относятся тонкомолотые порошки кварцевого песка, пемзы, мела и др., ко вторым – порошки электрокорундов, саморассыпающиеся шлаки из электропечей варки стали и др. Абразивные чистящие средства чаще всего выпускают в виде порошков и паст, реже в виде суспензий.
В состав чистящих средств входят анион и катион, активные вещества. Они растворяются в жирах – это алкилбензосульфаты, хлорид алкилдиметил-бензиламмоний. Некоторые из катионоактивных детергенов обладают сильным антимикробным действием, поэтому их применяют в составе чистящих средств для дезинфекции. Однако, если вещества при использова-нии могут оказывать вредное воздействие на здоровье человека, то это обстоятельство должно быть отображено в инструкции на информационном листе. Неионные детергенты проявляют высокую чистящую и моющую активность, но слабо образуют пену.
Последние успехи в разработке чистящих и моющих средств связаны с применением ферментов. Ферменты – это вещества, произведённые живыми организмами, которые способны катализировать биохимические реакции, т.е. они ускоряют реакцию, но сами при этом не изменяются. Определённые ферменты катализируют реакции, подобные тем, которые идут при переваривании пищи, поэтому они очень эффективны. Ферменты, входящие в состав препаратов бытовой химии безвредны и применяются в малых количествах. Чтобы у чистящих веществ был приятный запах, во все средства вводят парфюмерные отдушки. Существуют и другие функциональные добавки: гидраты – вещества, улучшающие растворимость компонентов; комплексообразователи – вещества связывающие соли железа. Глицерин и этиленгликоль (добавляют в пастообразные и суспензионные препараты) выполняют двойную роль: во-первых, предохраняют от быстрого высыха-ния, а, во- вторых, и это не менее важно, они действуют смягчающе на ко-жу рук. Многие чистящие средства не только хорошо очищают поверхность, но также уничтожают находящиеся на ней болезне-творные микроорганизмы, то есть обладают дезинфицирующими свойствами. Достигается это благодаря введению в их состав дезинфицирующих компонентов, например гипохлорита кальция или натрия, натриевых солей дихлоризоциануровой кислоты. Для трудных загрязнений выпускаются специальные средства с высоким дезинфицирующим эффектом.
Поступающие в продажу чистящие средства разделяются не только по составу, но и по свойствам. Они могут быть порошкообразные, жидкие, в виде гелей и пастообразные. Из всего многообразия этих средств необходимо выбрать те, которые вас больше устроят.
Преимущественно порошкообразных средств очевидно – они хорошо растворимы в воде, во многие порошкообразные вещества введены ПАВ, что значительно улучшает их качества. Однако порошкообразные при дозировании пылят, а некоторые люди плохо переносят эту пыль, раздражая органы дыхания. Кроме того, порошки трудно дозировать.
Пастообразные не пылят и компактны. В их состав входят такие ПАВ, которые в силу ряда технологических причин нельзя ввести в порошки. Они более мягко действуют на кожу рук. Однако они растворяются в воде медленнее и содержат в 1,5 – 2 раза меньше триполифосфатов (или их заменителей), чем порошкообразные.
Жидкие моющие средства, гели, пожалуй, обладают всеми преимуществами над пастообразными и порошкообразными. Необходимо помнить о том, что сухие вещества портят поверхность, оставляя царапины и делая блестящую поверхность шероховатой и матовой. Не надо брать препарат больше, чем написано на упаковке, это не усилит его свойства.
В зависимости от вида чистящие средства различного назначения выпускают в самой различной таре: в стеклянных или пластмассовых флаконах и банках, картонных и жестяных коробках, в комбинированных упаковках, тубах из алюминия и полимерных материалов.
Перечисленные выше условия, представляют основной перечень качественного состава препаратов бытовой химии. Далее дело за производителем, который добавляет и другие вещества, тем самым, делая препарат лучше (в большинстве случаев), дешевле и экологически более безопасным. Конечно, при этом основная забота ложиться на плечи химиков и технологов, которые должны создавать высокоэффективные, безвредные препараты для людей, животных и растений.
Чистящие средства легко попадают в воздух или оседают на открытых поверхностях, вызывая раздражение верхних дыхательных путей и различные аллергические реакции. Особенно важно покупать безопасную бытовую химию семьям с маленькими детьми.
Основные ингредиенты натуральных чистящих средств
Пищевая сода
Белый уксус (дистиллированный уксус)
Кастильское мыло
Лимон
Растительные масла
Эфирные масла (для придания аромата)
Пищевая сода
Пищевую соду можно использовать в качестве универсального натурального чистящего средства. Сода хорошо избавляет от всевозможных запахов, удаляет пятна с различных поверхностей.
Кремообразное чистящее средство на основе соды (рабочих поверхностей)
2 стакана пищевой соды
½ стакана жидкого кастильского мыла
4 ложки растительного глицерина (для консервации)
5 капель любого эфирного масла для отдушки (по желанию)
Уксус
Разведенный в воде уксус способен естественно очищать практически любые поверхности. Смешайте одну часть уксуса с одной частью воды, и вы получите универсальное чистящее средство. Уксус дезинфицирует и удаляет неприятные запахи. С его помощью можно удалять ржавчину, накипь, минеральные отложения на кранах, следы от клея и жевательной резинки. Уксусный запах исчезает сразу после высыхания поверхностей.
Универсальное натуральное чистящее средство (любые поверхности, полы на кухне)
1/4 стакана белого дистиллированного уксуса (от другого типа уксуса могут оставаться следы на поверхностях)
2 стакана воды
По желанию: несколько капель любого эфирного масла (апельсиновое, мятное и т.д.)
Сок лимона
Лимонный сок легко справляется с различного рода загрязнениями. Его можно использовать для удаления пятен ржавчины, чистки и полировки меди, латуни. При смешивании с растительными маслами, лимонный сок успешно полирует мебель или становится естественным отбеливателем под воздействием солнца.
Натуральное средство для мытья посуды
½ стакана жидкого кастильского мыла
½ стакана воды
1 ч. ложка лимонного сока
½ чашки белого уксуса
3 капли масла чайного дерева
Занятие 2.
Растворы, качественная и количественная характеристика.
Цель: познакомить учащихся со способами выражения состава раствора; научить учащихся решению задач на вычисление концентрации растворов.
Беседа:
Приготовление раствора.
Способы выражения концентрации раствора: молярная концентрация, массовая доля растворенного вещества в растворе.
Решение задач:
формулы для решения расчетных задач
массовая доля вещества W(в-ва)= m(в-ва)/ m(р-ра)
молярная концентрация С(в-ва)= n(в-ва) / V(р-ра) (моль/л = М)
Задачи
№1 Вычислите молярную концентрацию растворенного вещества:
если в растворе объемом 200 мл содержится гидроксид калия массой 5,6г
если в растворе объемом 0,65 литра содержится сульфат цинка массой 25,35г.
а) n(КОН)= 5,6/56=0,1 (моль) М(КОН)=56г/моль
С(КОН)=0,1/ 0,2= 0,5М
б) n(ZnSO4)=25,35/ 161=0,16 (моль)
M(ZnSO4)=65+32+16*4= 161г/моль
С(ZnSO4)=0,16/0,65=2,5М
№2 Определите массу растворенного вещества, содержащегося в следующих растворах:
раствор объемом 500 мл с концентрацией 0,1М КОН
раствор объемом 500 г с концентрацией 10% КОН
а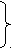 ) m(KOH)=M*n
) m(KOH)=M*n
n(KOH) =C*V(р-ра) m(KOH)= V(р-ра)*M(КОН)*C
m(КОН)= 0,5 * 56* 0,1=2,8 (г)
б) m(KOH)=m(р-ра)*w(в-ва)
m(KOH)= 500 *0,1=50 (г)
№3 Вычислите молярную концентрацию растворенного вещества в 300 г раствора с массовой долей гидроксида натрия 40%, плотность которого равна 1,4 г/мл.
С(в-ва)= n(в-ва) / V(р-ра)
V=m/p n=m/М m(в-ва)=m(р-ра)*w(в-ва)
m (NaOH)=300*0,4=120 (г) n(NaOH)=120/40=3(моль)
М(NaOH)=40г/моль
С(NaOH)=3/0,214=14 М
V(р-ра)=300/1,4=214(мл)
№4 К 200 г 10% раствора сульфата меди (II) добавили 23 г медного купороса. Чему равна массовая доля сульфата меди (II) в полученном растворе.
M(CuSO4)=160г/моль
M(CuSO4*5Н2О )= 250г/моль
n(CuSO4*5Н2О )=23/250=0,092(моль)
m(CuSO4)= 14,7(г)
m(CuSO4)общ= 14,7+200*0,1=34,7(г)
w(CuSO4)=34,7/223=15,6%
№5* Смешали 1л раствора с массовой долей гидроксида калия 10% ,
плотность 1,092 г/мл и 0,5 л раствора с массовой долей гидроксида калия 5%, плотность 1,045 г/мл. Объем смеси довели водой до 2л. Определите молярную концентрации растворенного вещества в полученном растворе.
m(KOH)=m(р-ра)*w(в-ва)
m1(р-ра)=1000мл*1,092г/мл=1092(г)
m1(KOH)=1092*0,1=109,2(г)
m2(р-ра)=500*1,045=522,5(г)
m2(KOH)=522,5*0,05=26,125(г)
mобщ(KOH)= 109,2+26,125=135,325(г)
n(КОН)=135,325/56=2,42(моль)
С=2,42/2=1,21(моль/л)
№6* Смешали 1л раствора с массовой долей гидроксида калия 10% ,
плотность 1,092 г/мл и 0.5 л раствора с массовой долей гидроксида калия 5%, плотность 1,045 г/мл. Объем смеси довели водой до 2л. Определите молярную и нормальную концентрации растворенного вещества в полученном растворе.
Занятие 3
Приготовление раствора с определенной концентрацией
Цель: — научить учащихся готовить раствор с определенной концентрацией, наблюдать, фиксировать и интерпретировать наблюдения.
Оборудование: химические стаканы, весы, дистиллированная вода, поваренная соль (твердая), гидроксид натрия (твердый), мерный цилиндр, стеклянные палочки.
Практическая работа №1
Задания:
Приготовить 50 г 10% водного раствора поваренной соли.
Приготовить 200 мл 0,1М водного раствора гидроксида натрия.
Методика
Произвести необходимые расчеты: вычислить массу растворяемого вещества и массу воды.
Взвесить необходимую массу вещества.
Поместить вещество в стакан.
Отмерить необходимый раствор воды, зная, что плотность воды 1 г/мл.
Прилить воду к веществу.
Тщательно перемешать полученный раствор.
Зафиксировать полученный результат, сделать выводы.
Занятие 4.
Вредные вещества, входящие в состав средств бытовой
химии и их влияние на здоровье человека.
Цель: изучить влияние средств бытовой химии на организм человека.
Лекция
При правильном использовании все препараты бытовой химии безопасны. В то же время совершенно безопасных соединений вообще не существует. Поэтому число несчастных случаев от контакта человека с этими веществами растет за последнее время. Главными источниками случайных отравлений служат:
Дезинфицирующие средства: растворы формальдегида, гипохлориды, соли аммония, фенолы.
Чистящие средства: аммиак, щелок (гидроксид натрия), фосфат натрия и полифосфаты, бура, борная кислота, карбонат натрия, щавелевая кислота, соляная кислота, четыреххлористый углерод, бензол, бензин, уайт-спирит, отбеливатели типа гипохлорита натрия и т.п.
Антифризы: этиленгликоль, метиловый спирт.
Гербициды: сульфамат аммония, соединения мышьяка, атразит, паракват.
Инсектициды: ДДТ, хлордан, линдан, никотин, фторид натрия, соединения таллия, пиретрин.
Другие токсические вещества, встречающиеся в быту: среди них: алколоиды, амилацетат, анилин, бром, бензол, бромистый этил, диметилсульфат, дихлорметиловый эфир, кислоты, метилформиат натрия, нитриты, перекись водорода, хлор, хлористый метил, эфиры. Например, хлор и аммиак – это газы с резким запахом. При незначительном содержании газа в воздухе, хлор оказывает обеззараживающее действие, но длительное вдыхание такого воздуха вызывает сильное раздражение слизистых оболочек дыхательных путей, жжение во рту и кашель, а порой приводит к смерти от удушья. Аммиак химически довольно активен и вступает во взаимодействие со многими веществами. Этот газ токсичен. Человек чувствует запах аммиака даже в малом количестве. При повышении концентрации проявляется раздражающее действие на слизистую оболочку глаз и верхних дыхательных путей. Последствия отравления аммиаком могут быть весьма тяжелыми – до снижения интеллекта и изменения личности.
Таким образом, все эти вещества могут попасть в организм через рот, легкие или кожу (либо адсорбироваться на коже при контакте с ней) и оказывать отрицательное действие на организм человека.
Используемые химические вещества можно классифицировать как:
— вещества местного действия, в их числе:
1) едкие вещества, разрушающие ткани при непосредственном контакте
( кислоты, едкие щелочи, соли);
2) раздражающие вещества, в частности соединения свинца, ртути, цинка, металлов;
3) вещества системного действия: они попадают в кровоток и воздействуют на сердце, почки, нервную систему и другие жизненно-важные органы (особенно цианиды, стрихнины и т.п.).
Многие ядовитые химические вещества, часто встречающиеся в быту, могут стать причиной отравления. Однако опасные химикалии могут вызывать не только острое отравление при случайном приеме внутрь; представляет опасность и продолжительный контакт с их парами, аэрозолями и распылителями. В тех случаях, когда эти вещества накапливаются в организме быстрее, чем выводятся из него, контакт с ними приводит к хроническим отравлениям. Как правило, тяжесть отравления, вызванного вдыханием токсического вещества, зависит от его концентрации и длительности вдыхания. Так, один и тот же эффект может быть вызван и за короткий промежуток времени, если концентрация вещества велика, и при продолжительном контакте, если его концентрация мала.
Симптомы отравления. Определить токсиканты только по симптомам чрезвычайно трудно. Перитонит и острое несварение желудка похожи на отравление кислотами и соединениями металлов. Снотворные, алкалоиды часто вызывают расширение или, наоборот, сужение зрачков. По запаху выдыхаемого воздуха можно определить отравление аммиаком, уксусной кислотой и цианидом (запах горького миндаля). Синюшность кожи (цианоз), появляющаяся при поверхностном дыхании, указывает на токсиканты с разъедающим действием, соединения свинца или ядовитые пищевые продукты. Повреждение ротовой полости и тканей желудка, сопровождающееся рвотой с кровью и слизью, вызывается отравлением сильными кислотами и щелочами. Головокружение, рвота и понос предполагают воздействие раздражителей желудочно-кишечного тракта, отравление пищевыми продуктами или соединениями металлов типа свинца, мышьяка и меди…
Лечение. В случае появления подобных симптомов следует немедленно вызвать врача и предоставить ему всю имеющуюся информацию.
Пополняется и перечень экологических заболеваний. Аллергия в нем — болезнь номер один, но она давно уже не одинока. К ней добавились такие распространенные недуги, как повышенная чувствительность к химикатам, синдром хронической усталости…
Вредные вещества — как преграды, о которые разбивается организм. Если барьер низок, можно миновать его без последствий для здоровья. Поэтому ученые подсчитывают предельно допустимые концентрации (ПДК) — обмеряют, какие барьеры мы перешагнем без вреда для себя. Однако и эта стратегия оказывается порочной. Каждый организм реагирует по-разному. Для многих ПДК — залог их здоровья. Однако для детей, больных людей и беременных женщин это не так.
Еще хуже дела у людей, страдающих повышенной чувствительностью к химикатам. Они часто жалуются на боли в суставах, быструю утомляемость, кожную сыпь, удушье, боль в сердце и депрессию. В одной лишь Германии около трех миллионов человек страдают от этой болезни. Они чувствительны даже к ничтожно малым дозам вредного для них вещества. Подобных больных опасности подстерегают всюду. В настоящее время в странах Европейского союза используется свыше ста тысяч промышленных химикатов. Каждый глоток воздуха может стать ингаляцией ядовитых молекул. В этой болезни пока много неясного: люди, страдающие гиперчувствительностью, — вовсе не аллергики; содержание иммуноглобулина Е или гистамина в их организме не повышается. Нельзя говорить и об отравлении: у «нормального» человека есть предел терпимости к химикатам; какую-то их дозу организм все же переносит. Здесь же концентрация вредного вещества бывает настолько мала, что никакие анализы не обнаруживают эту «понюшку» яда, а пациент валится с ног, места себе не находит. Согласно гипотезе Айрис Белл из Аризонского университета, заболевание начинается с отравления, которое не остается без последствий: теперь обонятельный нерв «по каждому пустяку» сигнализирует в головной мозг; у пострадавшего развивается гиперчувствительность; порог раздражения снижается настолько, что уже микродоза вызывает бурный эффект .
Проблема еще и в том, что вред, приносимый химией, трудно исправить. Да, экологам удается доказать, что вещество Х* (допустим, его содержат многие лаки и краски) постепенно поражает печень и почки. Его можно запретить, но прошлое — не компьютерный файл, в нем не сотрешь разом все Х*. Пока ограничиваются перебором наименований: вместо линдана и пентахлорфенола стали применять пиретроиды, вместо толуола и ксилола — гликоли.Их достоинство в том, что людям еще не приходилось по тридцать лет кряду жить в окружении этих химикатов.
Новые вещества могут обладать побочным действием, которое возможно предстоит открыть (с пиретроидами так и случилось). В среде экологов складывается убеждение: «Любой химикат ядовит; все решает лишь его доза». Поэтому необходимо помнить, что лицам с повышенной чувствительностью к химическим препаратам, страдающим аллергией, бронхиальной астмой, крапивницей, экземой, пользоваться средствами бытовой химии нужно особенно осторожно, тщательно соблюдая правила, указанные на упаковке средства бытовой химии.
Занятие 5.
Изучение состава чистящих средств по промышленным этикеткам.
Цель: изучить состав чистящих средств, составить таблицу по результатам своего изучения.
Оборудование: чистящие средства.
Практическая работа №2
Методика
Исследовать чистящие средства по составу: гидроксилсодержащие, кислотосодержащие, хлорсодержащие, карбонатсодержащие, гидроксид аммоний содержащие, хлорид аммоний содержащие.
Исследовать чистящие средства на наличие информации о мерах предосторожности и особенностях использования.
Зафиксировать полученные результаты, заполнить таблицы 1,2.
Группы чистящих средств
Таблица 1
| Кислот содержащие | Хлор содержащие | Гидроксид аммоний содержащие | Карбонат содержащие | Хлорид аммоний содержащие | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2
| Состав
| Меры предосторожности | Особенности использования | |
| | | | |
| | | | |
| | | | |
| | | | |
Занятие 6.
Изучение несовместимости средств по составу.
Цель: изучить совместимость использования чистящих средств на основе химических реакций.
Лекция.
Согласно анализу химической литературы, в основе большинства процессов лежат химические реакции. Некоторые препараты при совместном использовании теряют свою чистящую способность или образуют новые вещества с новыми свойствами (иногда вредные для здоровья человека). Могут быть несовместимы средства, содержащие в своем составе вещест-ва:
1) гидроксиды и кислоты
HCl + NaOH NaCl + H2O
Результатом такого процесса явилась реакция нейтрализации, при которой из двух веществ, которые являются основными компонентами чистящих средств, образовалась соль и вода. А значит, потерялась чистящая способность препаратов бытовой химии.
2) гипохлориды (хлораты, хлориты) и гидроксиды
NaCLlO + 2NH4OH N2 + 3Cl2 + 6NaOH
Результатом такого процесса является образование совершенно новых веществ, например свободный хлор, который, для определенной группы населения, является причиной заболевания или определенного дискомфорта.
3) карбонаты и кислоты
Na2CO3 + 2HCl 2NaCl + H2O + CO2
Результатом такого процесса является образование соли и газообразного вещества, а значит, вновь теряется чистящая способность средства.
4) соли аммония и гидроксиды
2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3
Результатом такого процесса является образование новых веществ, среди которых вредное для человека вещество аммиак.
Занятие 7.
Определение среды растворов чистящих веществ.
Цель: научить учащихся определять среду раствора при помощи индикаторов, совершенствовать умения пользоваться химическим оборудованием, наблюдать, фиксировать и интерпретировать наблюдения.
Оборудование: 10% растворы чистящих средств, индикаторы: лакмус, метиловый оранжевый, фенолфталеин, пробирки.
Практическая работа №3
Взаимодействие оснований с кислотами, приводящих к образованию соли и воды, называется реакцией нейтрализации. В результате рН среды меняется с кислотной (щелочной) на нейтральную. Реакция такого процесса выглядит следующим образом:
NaOH + HCl NaCl + H2O
Возможные методики определения кислотности среды
Кислотность среды определяется содержанием в растворе ионов Н+. Растворы веществ по-разному меняют цвет индикаторов. Индикаторами можно обнаружить кислотную, и щёлочную, и нейтральную среду.
Изменение цвета различных индикаторов при действии растворов
кислот и щёлочей
| Цвет индикатора в среде | |||
| Кислотная | щелочная | нейтральная | |
| Лакмус | Красный | Синий | Фиолетовый |
| Фенофталеин | Бесцветный | Малиновый | Бесцветный |
| Метиловый оранжевый | Розовый | Жёлтый | Оранжевый |
Методика
Приготовить 10% раствор чистящего средства согласно таблице 1
Раствор разлить в 3 пробирки
В каждую пробирку добавить 2-3 капли каждого индикатора.
Наблюдать возможное изменение окраски.
Зафиксировать полученный результат, сделать выводы.
Занятие 8.
Определение наличия хлора в чистящих веществах.
Цель: научить учащихся определять хлор в чистящих веществах, совершенствовать умения пользоваться химическим оборудованием, наблюдать, фиксировать и интерпретировать наблюдения.
Оборудование: 10% растворы чистящих средств, 10% раствор KI, хлороформ, пробирки,
Практическая работа №4
В аналитической практике хлор встречается в составе органических и неорганических соединений. В неорганических соединениях хлор чаще связан ионогенно и при соответствующей обработке переходит в водный раствор в виде ионов Cl— , ClO—, ClO2—, ClO3—, ClO4— , соответствующих соляной, хлорноватистой, хлористой, хлорноватой, хлорной кислотам. Наиболее яркой с точки зрения аналитической химии является реакция окисления кислородными кислотами йодид-иона, сопровождающаяся выделением свободного хлора. Реакция между гипохлорит- и иодид ионами имеет место в щелочном растворе: ClO— + I— + H2O I2 + Cl— + 2 OH—
Естественно, концентрация щелочи не должна быть столь высокой, чтобы происходило образование иодида и иодата по реакции:
3I2 + 6 OH— 5I— + IO3— + 3H2O
В кислых растворах взаимодействие между гипохлорит- и иодид-ионами происходит по уравнению:
ClO— + 2I— + 2 H+ I2 + Cl— + H2O.
Соответственно идут реакции с хлорат- и хлорит- ионами . Если в реакцию вступает не кислота, а соли данных кислот, то она проходит аналогично выше приведенной реакции:
1) 6 NaClO + NH4OH N2 + 3Cl2 + 6 NaOH ;
2) 2 KI + Cl2 2KCl + I2 .
Так как в результате реакции образовался йод, то его легко обнаружить с помощью йодкрахмальной бумаги или в присутствии бензола по характерному сине-фиолетовому окрашиванию.
Методика
Приготовить растворы чистящих средств, содержащих гипохлориды (таблица1) .
К 1 капле раствора KI прибавить несколько капель хлороформа.
Прибавить по 1 капле выше приготовленного раствора,
Хорошо взболтать содержимое пробирки.
Наблюдать возможное изменение окраски.
Зафиксировать полученный результат, сделать выводы.
Занятие 9.
Определение наличия карбонат-ионов в чистящих веществах.
Цель: научить учащихся определять карбонат-ионы в чистящих веществах, совершенствовать умения пользоваться химическим оборудованием, наблюдать, фиксировать и интерпретировать наблюдения.
Оборудование: 10% растворы чистящих средств, 2% раствор соляной кислоты, 2% раствор гидроксида кальция, пробирки,
Практическая работа №5
СО3 –ион является анионом угольной кислоты Н2СО3, которая неизвестна в свободном состоянии. При получении из солей она разлагается на СО2 и Н2О.
CaCO3 + 2HCl CaCL2 + H2CO3
H2CO3 H2O + CO2
CO2 можно обнаружить по помутнению известковой или баритовой воды, т.е. насыщенных растворов Ca(OH)2 и Ba(OH)2 :
Ca(OH)2 + CO2 СaCO3 + H2O
При длительном насыщении раствора CO2 помутнение может исчезнуть.
CaCO3 + CO2 + H2O Ca(HCO3)2
Методика
Реакцию проводят в приборе для обнаружение газов.
В пробирки поместить средства, содержащие карбонат-ионы (таблица1)
Прилить 2% раствор соляной кислоты.
Закрыть пробирку газоотводной трубкой, которая помещена в раствор гидроксида кальция.
Наблюдать помутнение раствора.
Зафиксировать полученный результат, сделать выводы.
Занятие 10.
Определение наличия ионов аммония в чистящих веществах.
Цель: научить учащихся определять наличие ионов аммония в чистящих веществах, совершенствовать умения пользоваться химическим оборудованием, наблюдать, фиксировать и интерпретировать наблюдения.
Оборудование: 10% растворы чистящих средств, 2% раствор соляной кислоты, 2% раствор гидроксида натрия, пробирки,
Практическая работа №6
Реакция с едкими щелочами.
NH4Cl + NaOH NaCl + H2O + NH3
В водном растворе аммиака, являющемся слабым основанием, существует следующее равновесие: Н2О + NH3 =NН4ОН, которое сдвинуто в сторону образования NН3. Едкие щелочи разлагают соли аммония, особенно при повышении температуры, с выделением аммиака.
Выделяющийся аммиак может быть обнаружен:
1. По посинению красной лакмусовой бумажки или по покраснению бесцветной фенолфталеиновой бумаги
2. По почернению фильтровальной бумаги, смоченной раствором нитрата ртути
 Hg
Hg


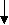 2Hg(NO3)2 + 2NH3 + H2O О NH2 NO3 +2Hg + 3NH4NO3
2Hg(NO3)2 + 2NH3 + H2O О NH2 NO3 +2Hg + 3NH4NO3
Hg
3. По выпадения желто-коричневого (или красно-бурого) осадка с реактивом Несслера ( щелочной раствор тетраиодомеркуриата калия)
NH4Cl + KOH NH3 + KCl + H2O
NH3 + 2HgI4 + OH NH2Hg2I3 + 5I2 + H2O
4. По выпадению белого осадка (гидроксида цинка) с растворами солей цинка
Zn(H2O)4Cl2 + 2 NH3 Zn(OH)2 + 2 NH4Cl +2 H2O
5. По выпадению зеленого осадка с основной солью никеля
Ni(H2O)4Cl2 + 2 NH3 Ni(OH)2 + 2 NH4Cl +2 H2O
Методика
Реакцию на аммиак можно проводят в газовой камере. К внутренней стороне предметного верхнего стекла прикрепляют влажную лакмусовую бумагу и рядом фильтровальную бумагу, смоченную нитратом ртути (или реактивом Несслера). На нижнее стекло помещается 2-3 капли исследуемого раствора, содержащего ионы аммония (таблица 1) и 3-5 капель раствора щелочи. Нижнее стекло накрывается верхним стеклом, и камера помещается на отверстие кипящей водяной бане. При наличии аммиака в растворе на бумаге появляется черное пятно.
В пробирку поместить каплю испытуемого раствора, прибавить 5-6 капель воды и 3-4 капли реактива Несслера, при этом выпадает желто-коричневый осадок.
Аммиак образует с растворами солей Zn белый порошок Zn(OH)2, который растворяется в избытке NH3, а также в кислотах и щелочах. К 1-2 каплям раствора соли Zn (II) прибавляем равный объем разбавленного раствора NH3. Выпадает белый аморфный осадок.
Аммиак образует осадок основной соли Ni (II), которая растворяется в избытке с образованием комплексной соли. К 1-2 каплям раствора соли Ni(II) по каплям прибавляют раствор NH3 до образования сине-зеленого цвета раствора.
Зафиксировать полученные результаты, сделать выводы.
Занятие 11.
Безопасная бытовая химия.
Цель: научить применению средств бытовой химии без вреда для организма человека.
Лекция
В последнее время значительное внимание уделяется не только составу, качеству средств, но и побочному действию этих веществ. Возможность развития побочных реакций связано с неправильным применением препаратов бытовой химии. Некоторые хозяйки действуют по принципу «Лей сразу всё, что-нибудь да поможет», даже не прочитав инструкций по применению. Оказалось, что некоторые из веществ в составе чистящих средств, подвергаясь различным влияниям, проявляют весьма интересные свойства.
Все препараты бытовой химии поступают в продажу по тщательной токсикологической и гигиенической проверки и разрешения Министерства здравоохранения РФ. При этом проверяется безопасность препаратов и при хранении (не выделяют ли они вредных веществ), и при использовании. Проверяют, не оказывают ли они вредного воздействия на организм человека, не вызывают ли аллергических реакций и т.д. Все это так, но при неправильном применении средства бытовой химии, несомненно, могут причинить вред. По степени опасности для человека препараты бытовой химии можно разделить на 4 группы: -6-
1. Безопасные (на их упаковке отсутствуют предупреждающие надписи):
синтетические моющие вещества
подсинивающие, подкрахмаливающие
чистящие
2.Относительно безопасные (надписи на упаковке: «Беречь от попадания в глаза»):
отбеливающие
дизинфецирующие
репеллентные средства
некоторые вещества по уходу за автомобилями
3. Ядовитые (надписи на упаковке «Яд», «Ядовито»)
средства борьбы с насекомыми, грызунами
пятно выводящие вещества
некоторые вещества по уходу за автомобилями
4. Огнеопасные (надписи на упаковке «Огнеопасно», «Не использовать вблизи огня»):
— препараты-аэрозоли
— содержащие растворитель
— жидкие средства защиты растений
— средства для борьбы с насекомыми
Способ чистки средствами бытовой химии одинаков: ванну, раковину или поверхность керамических плиток протирают влажной губкой с небольшим количеством порошка, пасты или жидкости, а потом смывают водой. При чистки с помощью дезинфицирующих препаратов допол-нительно выжидают 10-15 минут и только потом смывают водой.
Работа с химическими веществами не перенесет никакого вреда, если строго придерживаться определённых правил, которые диктуют техника безопасности и здравый смысл. Они просты, логичны, их легко усвоить
Все препараты бытовой химии должны храниться только в недоступных для детей местах, отдельно от пищевых продуктов, лекарств, обязательно иметь заводскую этикетку.
Не следует закупать большое количество препаратов впрок, т.к. по окончанию срока хранения пользоваться ими уже нельзя (т.к. вещества-энзимы разлагаются после года хранения содержащих их моющих средств, и средство становиться неэффективным), а во- вторых, в продажу поступают новые препараты лучше и эффективнее прежних.
Средства бытовой химии подлежат обязательному уничтожению, если прошел указанный срок хранения на упаковке, если этикетка с назва-нием препарата и указанием срока хранения утрачена, испорчена, надпись стала неразборчивой, если внешний вид препарата, его запах сильно изменился и т.д.
Применять любые препараты бытовой химии используют только в тех условиях, для тех целей, и с теми мерами предосторожности, как это подробно написано на упаковке или предлагаемой инструкции.
Особое внимание и аккуратность требуется при обработке квартиры токсичными и ядовитыми средствами против тараканов, клопов, и других насекомых. До начала работы из квартиры надо вынести аквариумы и клетки с птицами, удалить домашних животных, в помещении не должны находиться дети. Все продукты и посуду надо убрать в закрывающиеся шкафы и полки. Работу рекомендуется проводить, защитив рот марлевой повязкой (в 2-3 слоя). После окончания работы надо тщательно вымыть руки с мылом, закрыть все окна, а потом уйти самому и закрыть дверь. Спустя 2-4 часа помещение следует хорошо проветрить, поверхность кухонного и обеденного столов промыть тёплой водой с мылом.
Нельзя хранить пищевые продукты в таре, освободившейся из под средств бытовой химии, как бы тщательно вы ее не вымыли.
Сыпучие средства бытовой химии следует дозировать ложкой, жидкие – мерным колпачком, а переливать, пользуясь воронкой. Делать это надо осторожно, чтобы мелкая пыль или брызги не попадали в рот, нос, глаза. После окончания работы ложку и воронку надо тщательно вымыть и высушить; хранить их надо там же, где вы хранили соответствующие препараты и не пользоваться ими для других целей.
В последнее время часто бытовая химия выпускается в аэрозольных баллонах. Их нельзя давать в руки детям, даже если баллон уже пуст; нельзя хранить их возле газовых и электрических плит, батарей и других источников тепла.
Предупредительная надпись на упаковке «Беречь от мороза» означает, что препарат нельзя хранить при температуре ниже 0 C. Это относится в основном к жидким и пастообразным, клеящим, подкрахмаливающим средствам, т.к. они теряют полезные свойства.
Однако в жизни может случиться всё, поэтому необходимо знать меры первой помощи, оказываемые при случайных отравлениях и ожогах, получаемых при использовании препаратов бытовой химии.
Конечно, при любых отравлениях (и ожогах) надо немедленно обратиться к врачу, но до прихода необходимо оказать первую помощь, которая способствует либо удалению ядовитого продукта из организма, либо его обезвреживанию.
Часто эффективным средством для удаления яда является промывание желудка. Больному надо выпить несколько стаканов воды и вызвать рвоту. В воду можно добавить соль и сухую горчицу. При отравлении «Хлорофосом», «Карбофосом» в воду добавляют питьевую соду.
При отравлении каустической содой, препаратами бытовой химии, содержащих кислоты, промывать желудок перманганатом калия нельзя! Чтобы разбавить попавшую внутрь кислоту, надо выпить 2-3 (не более) стакана воды. Нельзя также «нейтрализовать» кислоту. При таком отравлении надо выпить яичные белки, или рисовый отвар. При отравлении йодом нужно выпить разведённый в воде крахмал.
Многие считают, что при отравлении полезно пить молоко, однако при большинстве отравлений молоко только способствует всасыванию ядов, которые хорошо в нём растворяются. Молоко рекомендуется пить при отравлении кислотами. А при попадании в глаза одеколона, бензина их промывают молоком.
Если на кожу всё-таки попали щелочь или кислота, их немедленно смывают большим количеством воды, а потом обрабатывают ожог питьевой содой, порошком мела или раствором лимонной, борной или очень разбавленной уксусной кислотой (если на кожу попала щелочь). Если пылинки или капельки вещества, пусть даже не едкого, попали в глаза, надо немедленно промыть пострадавший глаз обильной струей воды, наложить стерильную повязку и обязательно показать врачу.
В настоящее время появилось инновационная альтернативная основа для создания чистящих средств нового поколения. Используя ее неагрессивность, удалось отменить существовавшую годами аксиому, что нельзя соединить моющую основу (из-за ее агрессивности) с живой клеткой! В результате появилась уникальная серия продуктов решающих проблему нестандартным путём. Продукты подавляют развитие патогенной микрофлоры с помощью самих микроорганизмов! Эти содержат живые пробиотические бактерии и ферменты. Пробиотики как пищевые добавки уже не новость на рынке, но средства, о которых пойдёт речь, являются чистящими пробиотиками, то есть работают не только на поверхностях как дезинфицирующие вещества, но являясь бактериями, проникают глубоко вовнутрь, где и прячутся от агрессивных дезинфектантов патогены. То, что патогенные бактерии обитают в объеме и внутри, а не только на поверхности и объясняет кратковременность эффекта дезинфекции (через 3 часа после обработки поверхности количество патогенов восстанавливается, а пробиотиков падает до нуля). На данный момент эти уникальные продукты, не имеющие аналогов в мире, уже отлично показали себя в странах Западной Европы и, как ни странно, в России.
Чистящие пробиотики – уникальное моющее средство, которое уже внедрено во всех медицинских учреждениях стран Бенилюкса. Базовые свойства таких очистителей: универсальность (используются на всех видах поверхностей и материалов); мощная очищающая сила при абсолютной безопасности для человека, животных и всего окружающего нас мира, практически полная биоразлагаемость.
Современные химические препараты так точно вошли в нашу жизнь, что мы уже ни дня не можем прожить, не воспользовавшись ими. В среде экологов складывается убеждение: «Любой химикат ядовит; все решает лишь его доза». Поэтому необходимо помнить, что лицам с повышенной чувствительностью к химическим препаратам, страдающим аллергией, бронхиальной астмой, крапивницей, экземой, пользоваться средствами бытовой химии нужно особенно осторожно, тщательно соблюдая правила, указанные на упаковке средства бытовой химии. Химия наш друг и помощник, но в неумелых руках она может оборачиваться и врагом….
Занятие 12.
Презентация творческих проектов.
Чистящие средства на моей кухне.
Вред или польза от чистящих средств.
Безопасная опасная химия.
Развитие бытовой химии.
Жизнь человека без химического производства.
